某化学兴趣小组用含有铝、铁、铜的合金制取纯净的氯化铝溶液、绿矾晶体[FeSO4·7H2O]和胆矾晶体,以探索工业废料的再利用。其实验方案如下:
请回答下列问题:
(1)写出合金与烧碱溶液反应的离子方程式 。
(2)由滤液A制AlCl3溶液的途径有①和②两种,你认为合理的是 ;上述实验方案多处采用了过滤操作,过滤所用到的玻璃仪器有 和玻璃棒;其中玻璃棒的作用是 。
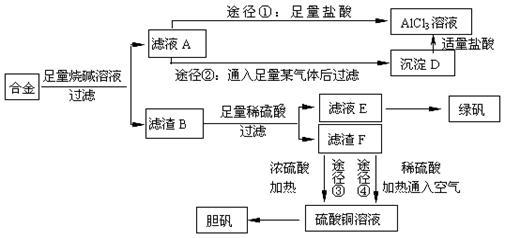
(3)用滤渣F通过两种途径制取胆矾,与途径③相比,途径④明显具有的两个优点是: 、 。
(4)通过途径④制取胆矾,必须进行的实验操作步骤:加硫酸、加热通氧气、过滤、 、冷却结晶、 、自然干燥。其中“加热通氧气”所起的作用为(用离子方程式表示) 。
 (5)测定所得胆矾(CuSO4·xH2O)中x值的实验方案是蒸发硫酸铜晶体中的水得到白色的无水硫酸铜,冷却后称量。此变化的化学方程式为:CuSO4·xH2O===CuSO4+xH2O,但温度过高,CuSO4会继续分解为CuO和SO3。在此实验中,下列操作对测定结果x值的影响是(填“偏高”、“偏低”、“无影响”)。
(5)测定所得胆矾(CuSO4·xH2O)中x值的实验方案是蒸发硫酸铜晶体中的水得到白色的无水硫酸铜,冷却后称量。此变化的化学方程式为:CuSO4·xH2O===CuSO4+xH2O,但温度过高,CuSO4会继续分解为CuO和SO3。在此实验中,下列操作对测定结果x值的影响是(填“偏高”、“偏低”、“无影响”)。
a.加热温度过高____________
b.加热时胆矾晶体飞溅出来____________
c.所用坩埚事先未干燥(潮湿)____________
下图是实验室制取乙酸乙酯的实验装置。请回答:
(1)在M试管中加碎瓷片的作用是。
试管N中盛放的溶液是_________________ 。
该溶液的作用为中和乙酸,吸收挥发出的乙醇,;
导管在其 液面上而不插入液面下的原因是。
(2)在大试管中配制一定比例的乙醇、浓硫酸和乙酸
混合液时,加入试剂的顺序是。
(3)浓硫酸的作用是。
(4)反应结束后,试管N内的液体分成两层,反应生成的乙酸乙酯在层(填写“上”或“下”)。若分离N中的液体混合物需要用到的玻璃仪器是烧杯、。
(5)M试管中发生反应的化学方程式。
(6)生成乙酸乙酯的反应是可逆反应,反应物不能完全变成生成物,反应一段时间后,
就达到了该反应的限度,也即达到化学平衡状态。下列描述能说明乙醇与乙酸的酯
化反应已达到化学平衡状态的是 (填序号)。
①单位时间里,生成1mol乙酸乙酯,同时生成1mol水
②单位时间里,生成1mol乙酸乙酯,同时生成1mol乙酸
③单位时间里,消耗1mol乙醇,同时消耗1mol乙酸
如图装置可以用来制取某些气体。
(1)该装置可以制备乙炔气体,圆底烧瓶中盛放的物质是(填化学式)。
(2)还能用该装置制备和收集的气体有(答出任意一种即可)。
(3)若用来制备乙烯气体,需要对装置进行改进,将分液漏斗改成温度计,温度计的水银球放置的位置是,改进时还需要的玻璃仪器是;反应的化学方程式是。
某实验小组用下列装置进行乙醇催化氧化的实验。已知:乙醛可被氧化为乙酸。
⑴实验过程中铜网出现红色和黑色交替的现象,请写出相应的化学方程式______________________、______________________。
⑵在不断鼓入空气的情况下,熄灭酒精灯,反应仍能继续进行,说明该乙醇催化反应
是反应。
⑶若试管a中收集到的液体用紫色石蕊试纸检验,试纸显红色,说明液体中还含有。要除去该物质,可在混合液中加入 (填写字母)。
| A.氯化钠溶液 | B.苯 | C.碳酸氢钠溶液 | D.四氯化碳 |
然后,再通过(填实验操作名称)即可除去。
实验室合成乙酸乙酯的步骤如下:在圆底烧瓶内加入乙醇、浓硫酸和乙酸,瓶口竖直安装通有冷却水的冷凝管(使反应混合物的蒸气冷凝为液体流回烧瓶内),加热回流一段时间后换成蒸馏装置进行蒸馏(如下图所示),得到含有乙醇、乙酸和水的乙酸乙酯粗产品。请回答下列问题: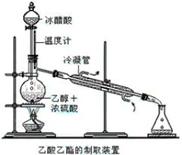
(已知:乙醇、乙酸、乙酸乙酯的沸点依次是78.4℃、118℃、77.1℃)
(1)在烧瓶中加入一定比例的乙醇和浓硫酸的方法是:
。
(2)在该实验中,若用1mol乙醇和1mol 乙酸在浓硫酸作用下加热,充分反应,生成乙酸乙酯的物质的量小于1mol,原因是。
(3)现拟分离含乙酸、乙醇和水的乙酸乙酯粗产品,下图是分离操作步骤流程图。请在图中圆括号内填入适当的试剂,在方括号内填入适当的分离方法。
试剂a是__________;分离方法①是_________________,
分离方法②是__________________,分离方法③是_______________。
(4)在得到的A中加入无水碳酸钠粉末,振荡,是。
(16分)选择恰当的试剂和方法除去下列物质中的少量杂质(括号内为杂质)
(1)C2H6(C2H4)试剂__________,方法________________________________________。
(2)溴苯(溴)试剂__________,方法___________________________________________。
(3)苯(甲苯)试剂________,方法____________________________________________。
(4)含有杂质的工业乙醇的蒸馏装置中,玻璃仪器有酒精灯、蒸馏瓶、_________、_________、尾接管、锥形瓶