工业上常用铁质容器盛装冷浓硫酸。为研究铁质材料与热浓硫酸的反应,某学习小组进行了以下探究活动:
[探究一]
(1)第一步:将已去除表面氧化物的铁钉(含少量碳元素)放入冷浓硫酸中,第二步:10分钟后移入硫酸铜溶液中,片刻后取出观察,铁钉表面 (填写第二步的实验现象,若有则写出具体现象,若无则写无明显变化),其原因是___________ ______。
(2)另称取铁钉6.0g放入15.0mL浓硫酸中,加热充分反应后得到溶液X并收集到气体Y。
① 甲同学认为X中除Fe3+外还可能含有Fe2+。若要确认其中有Fe2+,应先用________(选填序号)。
a.KSCN溶液和氯水 b.铁粉和KSCN溶液 c.酸性KMnO4溶液 d.浓氨水
铁粉与溶液X反应可制得一种补血剂, 写出其离子方程式 。
② 乙同学取336mL(标准状况)气体Y通入足量溴水中,发生反应:SO2+Br2+2H2O=2HBr+H2SO4,
然后加入足量 BaCl2溶液,经适当操作后得到干燥固体2.33g。由此推知气体Y中SO2的体积分数为__________________。
[探究二]分析上述实验中SO2体积分数的结果,丙同学认为气体Y中还可能含有H2和Q气体。为此设计了下列探究实验装置(图中夹持仪器省略)。

(3)装置B中试剂的作用是____________。
(4)认为气体Y中还含有Q的理由是__________(用化学方程式表示)。
(5)为确认Q的存在,需在装置中添加M于__________(填序号)。
a.A之前 b. A-B间 c.B-C间 d.C-D间
(6)如果气体Y中含有H2,预计实验现象应是_________________ __
按下图所示装置进行实验,并回答下列问题:
(1)锌极为________极,电极反应式为 ;
铜极为________极,电极反应式为 ;
(2)石墨棒C1为________极,电极反应式为 ;
石墨棒C2附近发生的实验现象为 。
(3)当C2极析出224 mL气体(标准状况)时,锌的质量 (填“增加”或“减少”) g;
CuSO4溶液的质量 (填“增加”或“减少”) g。
工业上SnSO4是一种重要的硫酸盐,广泛应用于镀锡工业,其制备路线如下: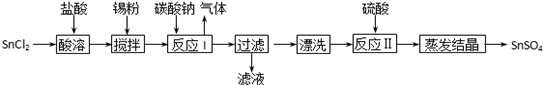
提示:①已知在酸性条件下,锡在水溶液中有Sn2+、Sn4+两种主要存在形式。
②已知Ksp[Sn(OH)2] =1.0×10-26
回答下列问题:
(1)SnCl2用盐酸而不用水直接溶解的原因是_____,加入Sn粉的作用是____。
(2)反应I生成的沉淀为SnO,写出该反应的离子方程式_______________。
(3)检验沉淀已经“漂洗”干净的方法__________________________。
(4)反应Ⅱ硫酸的作用之一是控制溶液的pH,若溶液中c(Sn2+)=1.0mol•L-1,则应控制溶液pH______。
(5)酸性条件下,SnSO4还可以用作双氧水去除剂,请写出发生反应的离子方程式________。
【改编】(15分)过氧化尿素是一种新型漂白、消毒剂,广泛应用于农业、医药、日用化工等领域。用低浓度的双氧水和饱和尿素溶液在一定条件下可以合成过氧化尿素,反应的化学方程式为: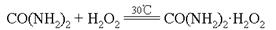 。过氧化尿素的部分性质如下:
。过氧化尿素的部分性质如下:
| 分子式 |
外观 |
热分解温度 |
熔点 |
溶解性 |
| CO(NH2)2·H2O2 |
白色固体 |
45℃ |
75~85℃ |
易溶于水、有机溶剂 |
合成过氧尿素的流程及反应装置图如下: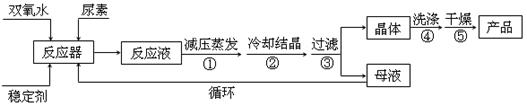
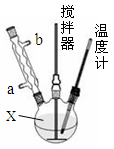
请回答下列问题:
(1)仪器X的名称是 ,冷凝管中冷却水从 (填“a”或“b”)口进入;
(2)反应器的加热方式是 ;
(3)搅拌器是否可用铁质材料 (填“是”或“否”),原因是 ;
(4)步聚①采用减压蒸发的原因是 ;
(5)下列选项中最适合作为步聚④的洗涤液是 ;
a.冰水
b.热水
c.饱和NaCl溶液
d.酒精和水的混合液
(6)准确称取0.5000g产品于250mL锥形瓶中,加适量蒸馏水溶解,再加1mL 6mol·L-1 H2SO4,用0.1000 mol·L-1 KMnO4标准溶液滴定至终点时消耗20.00mL(尿素与KMnO4溶液不反应),则产品中过氧化尿素的质量分数为 ;若滴定前滴定管尖嘴处有气泡,滴定后消失,则测得的过氧化尿素含量 (填“偏高”、“偏低”或“不变”)。
【改编】(15分)氨基甲酸铵(NH2COONH4)是一种白色固体,易分解、易水解,可用做肥料、灭火剂、洗涤剂等.某化学兴趣小组模拟制备氨基甲酸铵,反应的化学方程式如下:
2NH3(g) + CO2(g)  NH2COONH4(s)ΔH<0
NH2COONH4(s)ΔH<0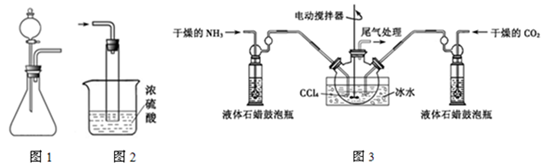
(1)如用图1装置制取氨气,你所选择的试剂是 。制备氨基甲酸铵的装置如图3所示,把氨气和二氧化碳通入四氯化碳中,不断搅拌混合,生成的氨基甲酸铵小晶体悬浮在四氯化碳中。当悬浮物较多时,停止制备。
注:四氯化碳与液体石蜡均为惰性介质。
(2)发生器用冰水冷却的原因是 。
(3)液体石蜡鼓泡瓶的作用是 。
(4)从反应后的混合物中分离出产品的实验方法是 (填写操作名称);为了得到干燥产品,应采取的方法是 (填写选项序号)。
a.常压加热烘干
b.高压加热烘干
c.真空40℃以下烘干
(5)尾气处理装置如图2所示。双通玻璃管的作用 ;浓硫酸的作用 。
(6)称取因部分变质而混有碳酸氢铵的氨基甲酸铵样品0.7820g,用足量石灰水充分处理后,使碳元素完全转化为碳酸钙,过滤、洗涤、干燥,测得质量为1.000g。则样品中氨基甲酸铵的物质的量分数为 。(精确到2位小数)
溴乙烷在不同溶剂中与NaOH发生不同类型的反应,生成不同的反应产物。某同学依据溴乙烷的性质,用如图所示的实验装置(铁架台、酒精灯略)验证取代反应和消去反应的产物,请你一起参与探究。
实验操作Ⅰ:在试管中加入5 mL 1 mol/L NaOH溶液和5 mL 溴乙烷,振荡。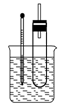
实验操作Ⅱ:将试管如图固定后,水浴加热。
(1)用水浴加热而不直接用酒精灯加热的原因是___________________________;试管口安装一长导管的作用是________________________________。
(2)观察到________________________现象时,表明溴乙烷与NaOH溶液已完全反应。
(3)为证明溴乙烷在NaOH乙醇溶液中发生的是消去反应,在你设计的实验方案中,需要检验的是________________________,检验的方法是_________________________________
(需说明:所用的试剂、简单的实验操作及预测产生的实验现象)。