在xR2+ +yH+ +O2=mR3+ +nH2O的离子方程式中,
(1)m=________(填数字)
(2)R3+是___________(填氧化产物、还原产物)
(3)用双线桥法表示电子转移的方向和数目___________
(4)若氧化等量的R2+,消耗的高锰酸钾与氧气的物质的量之比为___________,
重铬酸钾是工业生产和实验室的重要氧化剂,工业上常用铬铁矿(主要成份为FeO·Cr2O3)为原料生产,实验室模拟工业法用铬铁矿制K2Cr2O7的主要工艺如下,涉及的主要反应是:6FeO·Cr2O3+24NaOH+7KClO3 12Na2CrO4+3Fe2O3 +7KCl+12H2O,
12Na2CrO4+3Fe2O3 +7KCl+12H2O,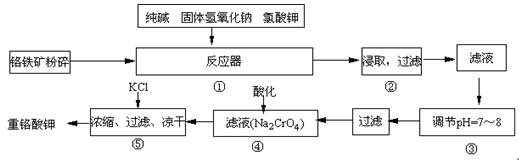
试回答下列问题:
(1)在反应器①中,有Na2CrO4生成,同时Fe2O3转变为NaFeO2,杂质SiO2、Al2O3与纯碱反应转变为可溶性盐,写出氧化铝与碳酸钠反应的化学方程式:
。
(2)操作③的目的是什么,用简要的文字说明:
。
(3)操作④中,酸化时,CrO42-转化为Cr2O72-,写出平衡转化的离子方程式:
。
(4)称取重铬酸钾试样2.5000g配成250mL溶液,取出25.00mL于碘量瓶中,加入10mL 2mol/LH2SO4和足量碘化钾(铬的还原产物为Cr3+),放于暗处5min,然后加入100mL水,加入3mL淀粉指示剂,用0.1200mol/LNa2S2O3标准溶液滴定。
(I2+2S2O32-=2I-+S4O62-)
①判断达到滴定终点的依据是:;
②若实验中共用去Na2S2O3标准溶液40.00mL,则所得产品中重铬酸钾的纯度(设整个过程中其它杂质不参与反应)%(保留小数点后两位)。
(15分)铝、铁、铜是应用最普遍的金属。
(1)铜是印刷电路工业的重要材料。用H2O2和H2SO4的混合溶液可溶出印刷电路板金属粉末中的铜,是工业上采用的方法之一。已知
Cu(s) + 2H+(aq) ="=" Cu2+(aq) + H2(g)△H= +64.39kJ/mol
2H2O2(l) ="=" 2H2O(l) + O2 (g)△H= ﹣196.46kJ/mol
H2(g) +1/2 O2 (g)="=" H2O(l)△H= ﹣285.84kJ/mol
在H2SO4溶液中Cu和H2O2反应生成Cu2+和H2O的热化学方程式为
(2)镁铝合金生活中应用广泛。取样品a克,溶于200ml 5mol/L的HCl溶液,收集到标况下氢气3.36L,a的取值范围,向反应后溶液中加入4mol/L NaOH溶液ml,沉淀质量达到最 大
大 值。
值。
(3)标准状况下,铁铜合金ag加入足量稀硝酸中,收集了一定量气体NO,在混合了67 .2mlO2后,可完全被H2O吸收,无气体剩余。则生成的NO为ml;向反应后溶液加足量的NaOH溶液,得到沉淀的质量g。(用含a的代数式表示)
.2mlO2后,可完全被H2O吸收,无气体剩余。则生成的NO为ml;向反应后溶液加足量的NaOH溶液,得到沉淀的质量g。(用含a的代数式表示)
水处理技术在工业生产和日常生活中有着重要应用。
(1)水处理絮凝剂包括无机絮凝剂和有机絮凝剂。无机絮凝剂如明矾,其原理用离子方程式表示为;有机絮凝剂如聚丙烯酸钠。 (2)氯气进行自来水消毒时,起消毒杀菌作用的物质是(写化学式),但用氯气消毒的水可能有臭味,长期饮用还可能对人造成潜在危害;ClO2是一种消毒杀菌效率高、二次污染小的水处理剂,工业上可用SO2与NaClO3溶液反应制得,该反应离子方程是。
(2)氯气进行自来水消毒时,起消毒杀菌作用的物质是(写化学式),但用氯气消毒的水可能有臭味,长期饮用还可能对人造成潜在危害;ClO2是一种消毒杀菌效率高、二次污染小的水处理剂,工业上可用SO2与NaClO3溶液反应制得,该反应离子方程是。
(3)高铁酸钠(Na2FeO4)作为水处理剂兼具絮凝剂和消毒杀菌剂的作用,被科学家们公认为绿色消毒剂。Na2FeO 4用于消毒杀菌,是利用其性;实验室采用次氯酸盐氧化法制高铁酸钠,在次氯酸钠溶液中加入氢氧化钠和硫酸铁,可制备高铁酸钠的稀溶液,该反应的离子方程式是。
4用于消毒杀菌,是利用其性;实验室采用次氯酸盐氧化法制高铁酸钠,在次氯酸钠溶液中加入氢氧化钠和硫酸铁,可制备高铁酸钠的稀溶液,该反应的离子方程式是。
某芳香烃X是一种重要的有机化工原料,有机化合物Y的分子式为 ,它们能按下图所示转化关系生成某种长效缓释阿司匹林(方框内物质均为有机物,无机产物已略去)。其中,E能使溴的四氯化碳溶液褪色,且分子中有1个甲基;G的蒸气密度是相同条件下H2密度的31倍,且分子中无甲基,1 molG与足量金属钠作用产生H222.4 L(标准状况)。
,它们能按下图所示转化关系生成某种长效缓释阿司匹林(方框内物质均为有机物,无机产物已略去)。其中,E能使溴的四氯化碳溶液褪色,且分子中有1个甲基;G的蒸气密度是相同条件下H2密度的31倍,且分子中无甲基,1 molG与足量金属钠作用产生H222.4 L(标准状况)。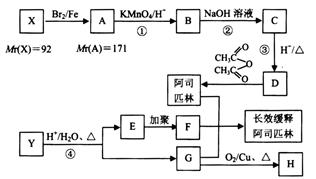
已知:
(i)阿司匹林又名乙酰水杨酸: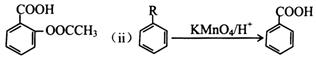
请回答:
(1) X的结构简式为__________, H分子中官能团的结构简式为__________;
(2) 反应②的化学方程式为__________,
反应①可否调至反应②、③之后进行?__________(选填“可以”或“不可以”),
请简述理由:___________________________________;
(3) 写出一种同时满足以下条件的D物质的同分异构体的结构简式_______________;
a.能发生银镜反应 b. 1个分子中含3个含氧官能团
c.苯环上一氯代物只有2种 d. 1mol有机物最多可消耗2mol NaOH
(4) 反应④的化学方程式为_______________;
(5) 阿司匹林、有机物F和G嫁接形成某种长效缓释阿司匹林,它能持续缓慢地释放出乙酰水杨酸,使人体能长时间存在乙酰水杨酸,用于抗血栓治疗。写出该长效缓释阿司匹林的结构简式_______________。
甲、乙分别是两种主族元素形成的氧化物,它们广泛存在于地壳中,均不溶于水,且都有如下相 同的转化关系,不同之处是乙对应的转化过程中需控制盐酸用量,若盐酸过量则得不到白色沉淀B。
同的转化关系,不同之处是乙对应的转化过程中需控制盐酸用量,若盐酸过量则得不到白色沉淀B。
(1) 写出甲、乙的化学式:甲________,乙________;
(2) 写出下列反应的化学方程式:
甲+NaOH溶液____________________________________________,
乙+NaOH溶液____________________________________________;
(3) 分别写出甲、乙对应的A溶液与过量盐酸反应的离子方程式:
甲 ________________________________________
乙______________ ______________________________
______________________________
(4) 若将5.1g乙溶于适量的盐酸(二者恰好完全反应)后,再加入175 mL的2 mol.L-1NH3H2O溶液,得到沉淀___________g