相同质量的钠在下列情况中产生氢气最多的是( )
| A.放在足量水中 | B.放在足量盐酸中 |
| C.放在足量CuSO4溶液中 | D.用刺有小孔的铝包好放入足量水中 |
下列各组离子在溶液中按括号内的物质的量之比混合,得到无色、碱性、澄清溶液的是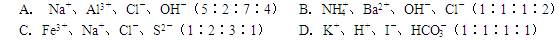
下列图象纵坐标表示沉淀量,横坐标表示加入x的物质的量,下列实验内容与图象正确的组合是
①NaAlO2溶液中滴入HCl②盐酸酸化的MgCl2、AlCl3溶液中滴入NaOH溶液③NaOH溶液中滴入AlCl3溶液④AlCl3 溶液中滴入NH3·H2O








| A.①a | B.②b | C.③c | D.④d |
能正确表示下列反应的离子方程式的是
| A.将铁粉加入稀硫酸中:2Fe+6H+===2Fe3++3H2↑ |
| B.将磁性氧化铁溶于盐酸:Fe3O4+8H+===3Fe3++4H2O |
| C.将氯化亚铁溶液和稀硝酸混合:Fe2++4H++NO3—===Fe3++2H2O+NO↑ |
| D.将铜屑加入含Fe3+的溶液中:2Fe3++Cu===2Fe2++Cu2+ |
在溶液中加入足量Na2O2后仍能大量共存的离子组是
下列关于胶体的认识错误的是
| A.鸡蛋清溶液中加入饱和(NH4)2SO4溶液生成白色沉淀,属于物理变化 |
| B.纳米材料微粒直径一般从几纳米到几十纳米(1 nm=10-9 m),因此纳米材料属于胶体 |
| C.往Fe(OH)3胶体中逐滴加入稀硫酸会产生沉淀而后沉淀逐渐溶解 |
| D.水泥厂、冶金厂常用高压电除去烟尘,是因为烟尘微粒带电荷 |