镍镉(Ni—Cd)可充电电池在现代生活中有广泛应用。已知某镍镉电池的电解质溶液为KOH溶液,其充、放电按下式进行:Cd + 2NiOOH + 2H2O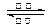 Cd(OH)2 + 2Ni(OH)2。有关该电池的说法正确的是:( )
Cd(OH)2 + 2Ni(OH)2。有关该电池的说法正确的是:( )
| A.充电时阳极反应:Ni(OH)2-e- + OH- ="=" NiOOH + H2O |
| B.充电过程是化学能转化为电能的过程 |
| C.放电时负极附近溶液的碱性不变 |
| D.放电时电解质溶液中的OH -向正极移动 |
改变反应条件使化学平衡向正反应方向移动时,下列变化中正确的是()
| A.生成物浓度一定增大 | B.生成物的物质的量分数一定增大 |
| C.反应物的转化率一定增大 | D.某生成物的产率可能提高 |
下列关于反应能量的说法正确的是()
| A.101kPa时,2H2(g)+O2(g)=2H2O(l) ΔH="-571.6" kJ/mol,H2的燃烧热为571.6 kJ·mol- |
| B.Zn(s)+CuSO4(aq)=ZnSO4 (aq)+Cu(s) ΔH="-216" kJ·mol-,反应物总能量>生成物总能量 |
| C.H+(aq)+OH-(aq)=H2O ΔH="-57.3" kJ·mol-,含1molNaOH的氢氧化钠的溶液与含0.5molH2SO4的浓硫酸混合后放出57.3kJ的热量。 |
| D.相同条件下,如果1molH所具有的能量为E1,1molH2所具有的能量为E2,则2 E1= E2 |
可逆反应2NO2 2NO+O2在恒容密闭容器中反应,可以作为达到平衡状态的标志是
2NO+O2在恒容密闭容器中反应,可以作为达到平衡状态的标志是
①单位时间内生成n mo1 O2的同时生成2nmol NO2
②单位时间内生成nmol O2的同时生成2nmolNO
③混合气体的颜色不再改变
④混合气体的密度不再改变的状态
⑤混合气体的平均相对分子质量不再改变的状态
| A.①③⑤ | B.②④⑤ | C.①③④ | D.①②③④⑤ |
反应A(g)+3B(g) 2C(g)+2D(g ),在不同情况下测得反应速率,其中反应速率最快的是()
2C(g)+2D(g ),在不同情况下测得反应速率,其中反应速率最快的是()
A.v (D)="0.4" mol / (L·s) B.v (C)="0.5" mol / (L·s)
C.v (B)="0.6" mol / (L·s) D.v (A)="0.15" mol / (L·s)
对平衡体系CO2 (g) CO2(aq) ΔH=-19.75kJ·mol-,为了减小温室效应的产生,增大二氧化碳气体在水中的溶解度,应采取的方法是()
CO2(aq) ΔH=-19.75kJ·mol-,为了减小温室效应的产生,增大二氧化碳气体在水中的溶解度,应采取的方法是()
| A.升温增压 | B.降温减压 | C.升温减压 | D.降温增压 |