室温下,下列各组离子在给定条件下一定能大量共存的是( )
| A.含有大量NO3—的水溶液中:NH4+、Fe2+、SO42-、H+ |
| B.在pH=12的溶液中:ClO—、SO32-、Na+、K+ |
| C.c(H+)=1.0×10-13mol/L溶液中:C6H5O-、K+、SO42-、Br- |
| D.能与铝粉反应生成氢气的溶液中:Na+、Al3+、CH3COOO—、I— |
在下列反应中, HCl 作氧化剂的是()
| A.NaOH+HCl=NaCl+H2O |
| B.Zn+2HCl=ZnCl2+H2↑ |
C.MnO2+4HCl(浓) 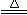 MnCl2+2H2O+Cl2↑ MnCl2+2H2O+Cl2↑ |
| D.CuO+2HCl=CuCl2+H2O |
11P+ 15CuSO4+ 24H2O = 5Cu3P+ 6H3PO4 + 15H2SO4反应中,被氧化的P原子与被还原的P原子个数比是 ()
| A.6:5 | B.5:6 | C.11:5 | D.11:6 |
在碱性溶液中能大量共存且溶液为无色透明的离子组是()
| A.K+、MnO4-、Na+、Cl- | B.K+、Na+、NO3-、CO32- |
| C.Na+、OH-、NO3-、SO42- | D.Fe3+、Na+、Cl-、S O42- O42- |
能用H++OH-=H2O来表示的化学反应是()
| A.氢氧化镁和稀盐酸反应 | B.Ba(OH)2溶液滴入稀硫酸中 |
| C.澄清石灰水和稀硝酸反应 | D.二氧化碳通入澄清石灰水中 |
下列反应属于氧化还原反应的是()
| A.MnO2+4HCl=MnCl2+Cl2↑+ 2H2O | B.CaO+H2O=Ca(OH)2 |
C.2H2O2 2H2O+O2↑ 2H2O+O2↑ |
D.CaCO3 CaO+CO2↑ CaO+CO2↑ |