有两种物质的量浓度相等的溶液,把它们等体积混合有白色沉淀生成,加入过量稀HNO3后,沉淀消失并放出气体,再加入AgNO3溶液又有白色沉淀生成,这两种溶液是 ( )
| A.Na2CO3和Ca(OH)2 | B.Na2CO3和CaCl2 |
| C.NaOH和CuSO4 | D.Na2SO4和Ba(NO3)2 |
.已知:①2C(s)+O2(g)====2CO(g)ΔH=-221.0 kJ·mol-1;②2H2(g)+O2(g) ====2H2O(g)ΔH=-483.6 kJ·mol-1。则反应C(s)+H2O(g) ====CO(g)+H2(g)的ΔH为()
| A.+262.6 kJ·mol-1 | B.-131.3 kJ·mol-1 |
| C.-352.3 kJ·mol-1 | D.+131.3 kJ·mol-1 |
向绝热恒容密闭容器中通入SO2和NO2,在一定条件下使反应SO2(g)+NO2(g)  SO3(g)+NO(g)达到平衡,正反应速率随时间变化的示意图如下所示。由图可得出的正确结论是( )
SO3(g)+NO(g)达到平衡,正反应速率随时间变化的示意图如下所示。由图可得出的正确结论是( )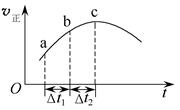
| A.反应在c点达到平衡状态 |
| B.反应物浓度:a点小于b点 |
| C.反应物的总能量低于生成物的总能量 |
| D.Δt1=Δt2时,SO2的转化率:a~b段小于b~c段 |
一定温度下,对于反应N2+O2 2NO在密闭容器中进行,下列措施能加快反应速率的是:
2NO在密闭容器中进行,下列措施能加快反应速率的是:
| A.改变温度 | B.恒容,充入N2 |
| C.恒容,充入He气 | D.恒压,充入He气 |
根据以下三个热化学方程式:
2H2S(g)+3O2(g)===2SO2(g)+2H2O(l)ΔH=-Q1 kJ·mol-1
2H2S(g)+O2(g)===2S(s)+2H2O(l)ΔH=-Q2 kJ·mol-1
2H2S(g)+O2(g)===2S(s)+2H2O(g)ΔH=-Q3 kJ·mol-1
判断Q1、Q2、Q3三者关系正确的是 ( )
| A.Q1>Q2>Q3 | B.Q1>Q3>Q2 |
| C.Q3>Q2>Q1 | D.Q2>Q1>Q3 |
把0.6 mol X气体和0.4 mol Y气体混合于2L容器中使它们发生如下反应,3X(g)+Y(g)  nZ(g)+2W(g),5 min末已生成0.2 mol W,若测知以Z浓度变化来表示的反应平均速率为0.01 mol·L-1·min-1,则上述反应中Z气体的反应方程式中n的值是( )
nZ(g)+2W(g),5 min末已生成0.2 mol W,若测知以Z浓度变化来表示的反应平均速率为0.01 mol·L-1·min-1,则上述反应中Z气体的反应方程式中n的值是( )
| A.1 | B.2 | C.3 | D.4 |