(14分)X、Y、Z、W是元素周期表中前四周期的常见元素,其相关信息如下表;
| 元素 |
相关信息 |
| X |
X的基态原子核外3个能级上有电子,且每个能级上的电子数相等 |
| Y |
原子最外层电子数是次外层的三倍 |
| Z |
单质及其化合物的焰色反应为黄色 |
| W |
W元素基态原子的M层全充满,N层只有一个电子 |
⑴ X位于元素周期表第 族 。X的一种单质熔点很高,硬度很大,则这种单质的晶体属于 晶体。
。X的一种单质熔点很高,硬度很大,则这种单质的晶体属于 晶体。
⑵ X与Y中电负性较强的是(填元素符号) ;XY2的电子式是 ,分子中存在 个σ键。
⑶Z2Y2中含有的化学键类型有 。阴、阳离子的个数比为 。
⑷W的基态原子核外电子排布式是 。
⑸废旧印刷电路板上有W的单质A。用H2O2和H2SO4的混合溶液可溶出印刷电路板上的A。已知:
A(s)+H2SO4(aq) ="=" ASO4(aq) + H2(g) ΔH=+64.4kJ·mol-1
2H2O2(l) ="=" 2H2O(l) + O2(g) ΔH= -196.4kJ·mol-1
H2(g)+ O2(g) ="=" H2O(l) ΔH= -285.8kJ·mol-1
O2(g) ="=" H2O(l) ΔH= -285.8kJ·mol-1
请写出A与H2SO4、H2O2反应生成ASO4(aq)和H2O(l)的热化学方程式(A用化学式表示):
。
A、B、C、D四种芳香族化合物都是某些植物挥发油中的主要成分,有的是药物,有的是香料。它们的结构简式如下所示: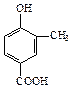
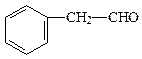
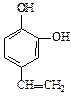
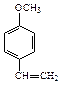
A BCD
回答下列问题:
(1)A中的含氧官能团名称是
(2)B与足量氢气充分反应的产物的结构简式为
(3)化合物C的分子式为 ,1 mol该物质完全燃烧需消耗 mol O2
(4)D发生聚合反应的产物的结构简式为
(5)A能与乙醇发生反应生成一种有特殊香味的物质,请写出该反应的方程式:
(6)关于上述四种物质的说法中正确的是
A.都能与Na反应放出H2
B.C、D均能使溴的四氯化碳溶液褪色
C.A和C均能与NaHCO3溶液反应放出CO2
D.1molC最多能与4molBr2发生反应
(相对原子质量:Na 23 O 16 H 1)
(1)配制物质的量浓度为0.2 mol/L的NaOH溶液500 mL,填空并请回答下列问题:
| 应称量NaOH的质量/g |
已给仪器 |
除已给仪器外还需要的其他仪器 |
| 烧杯、药匙、 托盘天平 |
(2)下列操作对配制的NaOH溶液浓度有偏高影响的是_______
| A.称量NaOH固体时,露置在空气的时间过长 |
| B.选用的容量瓶内有少量的蒸馏水 |
| C.在烧杯中溶解NaOH后,立即将所得溶液注入容量瓶中 |
| D.在定容时仰视容量瓶刻度线 |
(3)向0.1 mol/L的AlCl3溶液中加入过量的0.2 mol/L的NaOH溶液,则发生反应的离子方程式为
(4)将配制好的0.2 mol/L的NaOH溶液逐滴加入到0.1 mol/L的Ca(HCO3)2溶液中,则发生反应的离子方程式为
(20分)
工业上由丙烯经下列反应可制得F、G两种高分子化合物,它们都是常用的塑料。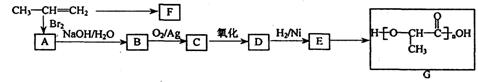
(1)聚合物F的结构简式是;
(2)D转化为E的化学方程式是;
A转化为B的反应类型是。
(3)在一定条件下,两分子E能脱去两分子水形成一种六元环状化合物,该化合物的结构简式是。
(4)E有多种同分异构体,写出3种含有一个羟基、一个酯基的E的同分异构体的结构简式:、、。
(5)已知:① ,
,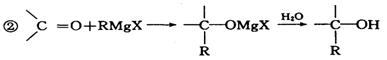
写出丙烯、甲醛等为原料合成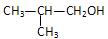 的反应流程图。
的反应流程图。
提示:①合成过程中无机试剂任选;②只选用本题提供的信息和学过的知识;③合成反应流程图表示方法示例如下:由乙醇合成二溴乙烷的反应流程图可表示为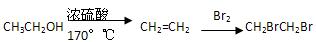
X、Y、Z、Q、E五种元素中,X原子核外的M层中只有两对成对电子,Y原子核外的L层电子数是K层的两倍,Z是地壳内含量(质量分数)最高的元素,Q的核电荷数是X与Z的核电荷数之和,E在元素周期表的各元素中电负性最大。请回答下列问题
(1)X、Y的元素符号依次为、:
(2)XZ2与YZ2分子的立体结构分别是和,相同条件下两者在水中的溶解度较大的是(写分子式),理由是
(3)Q的元素符号是,它属于第周期,它的核外电子排布式为,在形成化合物时它的最高化合价为;
(4)用氢键表示式写出E的氢化物溶液中存在的所有氢键
。
铅蓄电池是典型的可充型电池,它的正负极格板是惰性材料,电池总反应式为: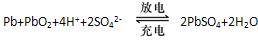
回答下列问题(不考虑氢、氧的氧化还原反应)
(1)放电时:正极的电极反应式是;电解液中H2SO4的浓度将变________,当外电路通过1mol电子时,理论上负极板的质量增加g。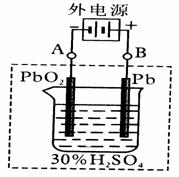
(2)在完全放电耗尽PbO2和Pb时,若按上图连接,电解一段时间后,则在A电极上生成__________,B电极上生成________,此时铅蓄电池的正负极的极性将____________。