现有3个体积相等的密闭容器,都进行下列反应:CO2(g) + H2(g) H2O(g) + CO(g),
H2O(g) + CO(g),
反应所处的温度相同,但起始浓度不同,其中 甲:n(CO2) = n(H2) = 1 mol;
乙:n(CO2)=1 mol,n(H2)=2mol; 丙:n(CO2)=n(H2)=1mol,n[H2,O(g)]=1 mol。
达到平衡时CO的物质的量由大到小的顺序是 ( )
| A.乙>甲>丙 | B.甲>丙>乙 | C.乙>丙>甲 | D.甲>乙>丙 |
二氧化硅(SiO2)又称硅石,是制备硅及其化合物的重要原料(见下图)。下列说法正确是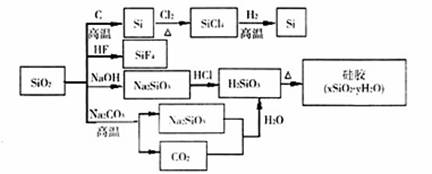
| A.SiO2既能与HF反应,又能与NaOH反应,属于两性氧化物 |
| B.玛瑙和红宝石的主要成分都是SiO2,SiO2和Si都是制造光导纤维的材料 |
| C.虽然高温下SiO2能与Na2CO3反应放出CO2,但不能说明硅酸的酸性强于碳酸 |
| D.图中所示转化反应中非氧化还原反应的种数少于氧化还原反应的种数 |
用NA表示阿伏加德罗常数值,下列叙述正确的是
| A.标准状况下,22.4 L己烷中共价键数目为19NA |
| B.7.1 g Cl2完全反应,转移的电子数一定为0.1NA |
| C.1 mol/L的Na2CO3溶液中含有NA个CO32- |
| D.CO2和O2组成的混合物中共有NA个分子,其中氧原子数为2NA |
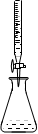
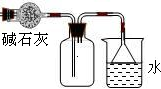
下列实验装置或现象正确的是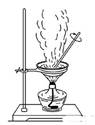

|
① ② ③④
A.利用装置①从氯化铁溶液中直接蒸发结晶获得氯化铁晶体下表是有关反应的离子方程式及对方程式的评价,其中方程式书写及对方程式正误评价均正确的是
| 编号 |
化学反应 |
离子方程式 |
评价 |
| A |
向NaHCO3 溶液中加入少量Ca(OH)2溶液 |
HCO3-+OH-+Ca2+ =CaCO3 ↓+H2O |
正确 |
| B |
少量SO2通入Ba(NO3)2溶液 |
3SO2+2NO3-+3Ba2++2H2O=3BaSO4 ↓+2NO ↑+4H+ |
错误 |
| C |
水杨酸与少量Na2CO3反应 |
2 +CO32- +CO32- 2 2 +CO2↑+H2O +CO2↑+H2O |
错误 |
| D |
H218O2中加入酸性高锰酸钾溶液 |
5H218O2+2MnO4-+6H+=2Mn2++518O2↑+8H2O |
正确 |
八种短周期元素的原子半径及某些化合价见下表。分析判断下列说法正确的是
| 元素代号 |
A |
D |
E |
G |
Q |
T |
X |
Z |
| 化合价 |
-1 |
-2 |
+4、-4 |
-1 |
+5、-3 |
+3 |
+2 |
+1 |
| 原子半径/nm |
0.071 |
0.074 |
0.077 |
0.099 |
0.110 |
0.143 |
0.160 |
0.186 |
A.A、T、Z的离子半径由大到小的顺序是A>Z>T
B.A的单质能将G单质从TG3的溶液中置换出来
C.Q元素的单质不存在同素异形体
D.X在ED2中燃烧生成两种化合物