有两只密闭容器A和B。A容器有一个可以移动的活塞能使容器内保持恒压,B容器能保持恒容。起始时向这两个容器中分别充入等物质的量的体积比为2∶1的SO2和O2的混合气体,并使A和B容积相等(如下图所示)。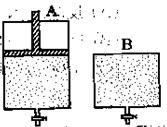
在保持400℃的条件下使之发生如下反应:2SO2+O2 2SO3。试填写下列空格:
2SO3。试填写下列空格:
(1)A容器达到平衡时所需的时间比B容器 ;(填“短”、“长”或“相等”)
平衡时A容器中SO2的转化率比B容器 ;(填“大”、“小”或“相等”)
(2)达到(1)所述平衡后,若向两容器中通入数量不多的等物质的量的氩气,A容器中化学
平衡 移动,B容器中化学平衡 ;(填“逆向”、“正向”或“不移动”)
(3)达到(1)所述平衡后,若向两容器中通入等物质的量的原反应气体,达到平衡时,A容
器的混合气体中SO3的体积分数 (填“增大”、“减小”或“不变”,下同);B容器的混合气体中SO3的体积分数 。
为防治碘缺乏病,通常在食盐中添加少量的碘酸钾(KIO3)。碘酸钾和碘化钾在溶液中能发生下列反应:KIO3+5KI+3H2SO4=3I2+3K2SO4+3H2O
(1)该反应中,氧化剂是________,氧化产物是______;
(2)当有1 mol I2生成时,有________ mol还原剂被氧化;
(3)当有1 mol氧化剂参与反应时,转移电子的数目为________。
现有以下物质①NaCl溶液②干冰(固态的二氧化碳)③冰醋酸(纯净的醋酸)④铜⑤BaSO4固体⑥蔗糖⑦酒精⑧熔融的KNO3⑨氨水⑩盐酸,其中能够导电的是_________________(填序号,下同);属于电解质的是__________________;属于非电解质的是___________________________。
在T℃时,向1 L固定体积的密闭容器M中加入2 mol X和1 mol Y,发生如下反应:2X(g)+Y(g)  aZ(g)+W(g) ΔH=-Q kJ/mol(Q>0);该反应达到平衡后,放出的热量为Q1 kJ,物质X的转化率为α;若平衡后再升高温度,混合气体的平均相对分子质量减小。
aZ(g)+W(g) ΔH=-Q kJ/mol(Q>0);该反应达到平衡后,放出的热量为Q1 kJ,物质X的转化率为α;若平衡后再升高温度,混合气体的平均相对分子质量减小。
请回答下列问题:
(1)化学计量数a的值为________。
(2)下列能说明该反应达到了化学平衡状态的是________(填序号)。
a.容器内压强一定
b.容器内气体的密度一定
c.容器内Z的分子数一定
d.容器内气体的质量一定
(3)维持T℃温度不变,若起始时向容器M中加入2 mol X、1 mol Y和1 mol Ar(稀有气体不参与反应),则反应达到平衡后放出的热量是________kJ。
(4)维持T℃温度不变,若在一个和原容器体积相等的恒压容器N中加入2 mol X和1 mol Y,发生题给反应并达到平衡,则________(填“M”或“N”)容器中的反应先达到平衡状态,容器中X的质量分数M________N(填“>”、“<”或“=”)。
(5)已知:该反应的平衡常数随温度的变化情况如表所示:
| 温度/℃ |
200 |
250 |
300 |
350 |
| 平衡常数K |
9.94 |
5.2 |
1 |
0.5 |
若在某温度下,2 mol X和1 mol Y在容器M中反应并达到平衡,X的平衡转化率为50%,则该温度为________℃。
(6)维持T℃温度不变,若起始时向容器M中加入4 mol X和6 mol Y,反应达到平衡时容器内的分子数目减少10%,则反应中放出的热量为________kJ。
电解原理在化学工业中有广泛应用。右图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题: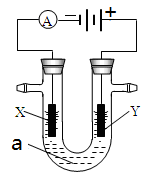
(1)若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则
①电解池中X极上的电极反应式为。在X极附近观察到的现象是。
②Y电极上的电极反应式为,检验该电极反应产物的方法是。
(2)如要用电解方法精炼粗铜,电解液a选用CuSO4溶液,则
①X电极的材料是,电极反应式是。
②Y电极的材料是,电极反应式是。
(说明:杂质发生的电极反应不必写出)
摩托罗拉公司开发了一种以甲醇为原料,以KOH为电解质的用于手机的可充电的高效燃料电池,充一次电可以连续使用一个月。已知该电池的总反应式为:
2CH3OH+3O2+4KOH 2K2CO3+6H2O
2K2CO3+6H2O
请填空:
(1)放电时:负极的电极反应式为_________________________________________________________。
(2)通入甲醇一端的电极是________极,电池在放电过程中溶液的pH将_______ (填“上升”、“下降”或“不变”)。
(3)若在常温、常压下,1 g CH3OH燃烧生成CO2和液态水时放出22.68 kJ的热量,表示该反应的热化学方程式为________________________________________________________________________。