NA表示阿伏加德罗常数。下列说法正确的是
| A.7.8 g Na2O2中含有的阴离子数目为0.2 NA |
| B.标准状况下,2.24 L SO3的分子数为0.1 NA |
| C.9.2 g NO2和N2O4的混合气中含有的氮原子数为0.2 NA |
D.1 L 0.1 mol/L Al2(SO4)3溶液中,Al3+的 数目为0.2 NA 数目为0.2 NA |
合成氨反应:N2(g)+3H2(g) 2NH3(g) △H ,若该反应在一定条件下能自发,则有关该反应的△H、△S判断正确的是()
2NH3(g) △H ,若该反应在一定条件下能自发,则有关该反应的△H、△S判断正确的是()
| A.△H <0 △S<0 | B.△H<0 △S>0 |
| C.△H>0 △S<0 | D.△H>0 △S>0 |
对于可逆反应:2SO2(g)+O2(g) 2SO3(g) ΔH<0,下列研究目的和示意图相符的是()
2SO3(g) ΔH<0,下列研究目的和示意图相符的是()
| A |
B |
C |
D |
|
| 研究目的 |
压强对反应的影响(p2>p1) |
温度对反应的影响 |
平衡体系增加O2的浓度对反应的影响 |
体积恒定的密闭容器中催化剂对反应的影响 |
| 示 意 图 |
 |
 |
 |
 |
将等物质的量的X、Y气体充入某密闭容器中,在一定条件下,发生如下反应并达到平衡:X(g)+3Y(g) 2Z(g);△H<0。当改变某个条件并维持新条件直至新的平衡时,下表中关于新平衡与原平衡的比较正确的是()
2Z(g);△H<0。当改变某个条件并维持新条件直至新的平衡时,下表中关于新平衡与原平衡的比较正确的是()
| 改变条件 |
新平衡与原平衡比较 |
|
| A |
升高温度 |
X的转化率变小 |
| B |
增大压强 |
X的浓度变小 |
| C |
充入一定量Y |
Y的转化率增大 |
| D |
使用适当催化剂 |
X的体积分数变小 |
以下物质间的每步转化通过一步反应能实现的是()
| A.Al—Al2O3—Al(OH)3—NaAlO2 | B.Fe—FeCl3—Fe(OH)2—Fe(OH)3 |
| C.S—SO3—H2SO4—MgSO4 | D.N2—NO—NO2—HNO3 |
在密闭容器中将CO和水蒸气的混合物加热到800℃时,有下列平衡:CO+H2O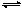 CO2+H2,且K=1。若用2molCO和10mol H2O相互混合并加热到800℃,则CO的转化率为()
CO2+H2,且K=1。若用2molCO和10mol H2O相互混合并加热到800℃,则CO的转化率为()
| A.16.7% | B.50% |
| C.66.7% | D.83.3% |