下列有关物质的性质、用途相对应都正确的是
| A.氯气具有还原性,可用于自来水的消毒杀菌 |
| B.水晶是无色透明的晶体,可用制作硅太阳能电池 |
| C.常温下铝在浓硫酸中钝化,常温下可用铝制容器盛放浓硫酸 |
| D.氨气可以和酸反应,氨气和硫酸反应只能得到硫酸铵 |
某实验小组学生用50 mL 0.50 mol/L的盐酸与50 mL 0.55 mol/L的NaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量计算反应热,下列说法正确的是() 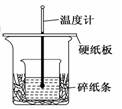
| A.如图条件下实验过程中没有热量损失 |
| B.图中实验装置缺少环形玻璃搅拌棒 |
| C.烧杯间填满碎纸条的作用是固定小烧杯 |
| D.若改用60 mL 0.50 mol/L盐酸跟50 mL 0.55 mol/L的NaOH溶液进行反应,理论上所求反应热偏高。 |
碳酸(H2CO3)是二元弱酸,碳酸氢钾溶液呈碱性。在0.1mol/LKHCO3溶液中,下列关系正确的是()
| A.c(K+)+c(H+)=c(HCO3-)+c(OH-)+c(CO32-) | B.c(HCO3-)+c(CO32-)="0.1" mol/L |
| C.c(CO32-)>c(H2CO3) | D.c(K+)+ c(OH-)=c(HCO3-)+c(H+)+2c(H2CO3) |
在0.1 mol/L的NaAc(醋酸钠)溶液中,欲使c(Na+)/c(Ac-)比值减小,可采取的措施是()
| A.加热 | B.加少量水 | C.加少量盐酸 | D.加少量醋酸钠晶体 |
下列事实能说明亚硝酸是弱电解质的是()
| A.0.1mol/L亚硝酸溶液使pH试纸变红 | B.用亚硝酸溶液做导电试验,灯泡很暗 |
| C.亚硝酸溶液不与硫酸钠溶液反应 | D.常温下亚硝酸钠溶液的pH大于7 |
在蒸发皿中加热蒸干下列物质的溶液,并在空气中灼烧,可以得到该物质的固体的是()
| A.氯化铁 | B.亚硫酸钠 | C.碳酸氢铵 | D.偏铝酸钠 |