无铁硫酸铝是制造高档纸张和高级织物的重要原材料,制取无铁硫酸铝的工艺流程如下图所示。铝土矿酸溶后得到含铁(Fe2+和Fe3+)的硫酸铝溶液,再经过后续加工,最终得到成品无铁硫酸铝(溶液中各种金属离子开始沉淀和沉淀完全时的pH见表)。
(1) 试剂X可以用下列试剂中的__________(填编号)
a.铝土矿粉 b.氢氧化钠 c.氧化钙
| |
开始 |
完全 |
| Fe2+ |
7.6 |
9.7 |
| Fe3+ |
2.7 |
3.7 |
| Al3+ |
3.3 |
5.0 |
| Mn2+ |
8.3 |
9.8 |
(2)生产中控制pH为3而不大于3的原因是_________________ ;
(3)除铁时,必须先加入高锰酸钾溶液,目的是_____________________;高锰酸钾溶液和硫酸锰溶液反应生成活性二氧化锰,写出反应的化学方程式____________________ ;
(4)滤渣的含铁成分是__________;
(5)活性二氧化锰能和Fe(OH)3发生吸附共沉作用,用化学平衡理论解释活性二氧化锰的作用____________ 。
科学家一直致力于“人工固氮”的方法研究。目前合成氨的技术原理为氮气和氢气在高温高压催化剂条件下生成氨气:
(1)已知:N2(g)+O2(g)=2NO(g) ;△H= +180.5kJ·mol-1
4NH3(g)+5O2(g)=4NO(g)+6H2O(g) ;△H=﹣905kJ·mol-1
2H2(g)+O2(g)=2H2O(g) ;△H=﹣483.6kJ·mol-1
请写出氮气和氢气在高温高压催化剂条件下生成氨气的热化学方程式:。
(2)氨气在纯氧中燃烧,生成一种单质和水,试写出该反应的化学方程式:,科学家利用此原理,设计成氨气一氧气燃料电池,则通入氨气的电极是(填“正极”或“负极”);碱性条件下,该电极发生反应的电极反应式为。
(3)一定条件下,某密闭容器中发生反应:4NH3(g)+5O2(g) 4NO(g)+6H2O(g)。
4NO(g)+6H2O(g)。
①写出该反应的平衡常数表达式:K=。
②在一定体积的密闭容器中,为使该反应的反应速率增大,且平衡向正反应方向移动,下列措施中可采用的是(填字母代号)。
a.增大压强 b.适当升高温度 c.增大O2的浓度 d.选择高效催化剂
Ⅰ.在体积为2 L的密闭容器中,充入lmol CO2和2.6mol H2,一定条件下发生反应:CO2 (g)+3 H2 (g) CH3OH(g)+H2O(g) ;△H=﹣49.0 kJ · mol-1。测得CO2和CH3OH (g)的浓度随时间变化如图所示:
CH3OH(g)+H2O(g) ;△H=﹣49.0 kJ · mol-1。测得CO2和CH3OH (g)的浓度随时间变化如图所示: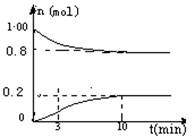
|
 2NH3(g);△H<0。反应达到平衡后,测得混合气体为7体积。
2NH3(g);△H<0。反应达到平衡后,测得混合气体为7体积。

U、V、W、X、Y、Z是原子序数依次增大的六种常见元素。Y的单质在W2中燃烧的产物可使品红溶液褪色。Z和W元素形成的化合物Z3W4具有磁性。U的单质在W2中燃烧可生成UW和UW2两种气体。X的单质是一种金属,该金属在UW2中剧烈燃烧生成黑、白两种固体。请回答下列问题:
(1)V的单质分子的结构式为_______;XW的电子式为________;Y元素在周期表中的位置是___。
(2)U元素形成的同素异形体的晶体类型可能是(填序号)。
① 原子晶体② 离子晶体③ 分子晶体④ 金属晶体
(3)U、V、W形成的10电子氢化物中,U、V的氢化物沸点较低的是(写化学式)___________;
V、W的氢化物分子结合H+能力较强的是(写化学式)______________。
(4)YW2气体通人BaCl2和HNO3的混合溶液,生成白色沉淀和无色气体VW,有关反应的离子方程式为_________;由此可知VW和YW2还原性较强的是(写化学式)__________________。
银器皿日久表逐渐变成黑色,这是由于生成了Ag2S,有人设计了用原电池原理加以除去,其处理方法为:将一定浓度的食盐溶液放入一铝制容器中,再将变黑的银器浸入溶液中与容器接触,放置一段时间,黑色就会褪去而不会损失。试回答:
在此原电池反应中,负极发生的反应为:__________________,正极反应为:________,反应过程中产生臭鸡蛋气味的气体,则原电池总反应方程式为:____________。
(1)铅蓄电池放电时发生下列反应负极:Pb+SO42--2e-=PbSO4正极:PbO2+4H++SO42-+2e-=PbSO4+2H2O,用该电池电解CuSO4溶液,当有纯铜1.6g析出时,铅蓄电池内消耗硫酸物质的量为_______。
(2)锌、溴蓄电池的充、放电的电池总反应为Zn+Br2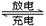 Zn2++2Br-。下列各反应①Zn-2e-====Zn2+②Br2+2e-====2Br-③2Br--2e-====Br2④Zn2++2e-====Zn,其中充电时的阳极反应式为,放电时负极的反应式是。
Zn2++2Br-。下列各反应①Zn-2e-====Zn2+②Br2+2e-====2Br-③2Br--2e-====Br2④Zn2++2e-====Zn,其中充电时的阳极反应式为,放电时负极的反应式是。
(3)目前人们正研究开发一种高能电池一—钠硫电池,它是以熔融的钠、硫为两极,以Na+导电的β,,——Al2O3陶瓷作固体电解质,反应如下:2Na+xS 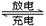 Na2Sx,其正极反应式为,当外电路转移4mol电子时消耗硫单质的质量为。
Na2Sx,其正极反应式为,当外电路转移4mol电子时消耗硫单质的质量为。