近几年我国某些城市酸雨污染较为严重,主要是因为大量燃烧含硫量高的煤而形成的,此外,各种机动车排放的尾气也是形成酸雨的重要原因。
【提出问题】通 过实验证明煤中含有碳元素和硫元素。
过实验证明煤中含有碳元素和硫元素。
【查阅资料】(1)“二氧化硫能使高锰酸钾溶液褪色(由紫红色变为无色),该反应的化学方程式为:5SO2 + 2 KMnO4 + 2H2O = K2SO4 + 2MnSO4 + 2 X ”。这个化学方程式中最后一种物质X的化学式是: 。
KMnO4 + 2H2O = K2SO4 + 2MnSO4 + 2 X ”。这个化学方程式中最后一种物质X的化学式是: 。
(2)“二氧化硫和二氧化碳一样,也能使澄清石灰水变浑浊。”请写出二氧化硫与澄清石灰水反应的化学方程式:______________________。根据上述资料,甲同学、乙同学和丙同学分别设计实验方案进行探究。
【实验探究】(3)甲同学:
“实验操作”:甲同学进行了如下图所示A、B两步实验:
“实验现象”: A中稀高锰酸钾溶液褪色,B中澄清石灰水变浑浊。
“得出结论”:煤燃烧生成二氧化硫和二氧化碳,证明煤中含有碳元素和硫元素。
(4)乙同学认为甲同学的实验方案不合理,其理由是: 。
(5)丙同学:
“实验操作”:丙同学进行了如下图所示实验(部分装置在图中略去):
【探究与结论】(6)上图C装置的作用是 。
(7)要证明煤中含有碳元素和硫元素的现象是:丙同学的实验中 。
钢铁是使用最多的金属材料。在今年的化学活动周中,某校兴趣小组的同学在老师指导下做了以下有关铁的实验:用干燥纯净的一氧化碳还原氧化铁实验装置如下图:
 |
A B C D E F
其中A是实验室用草酸(H2C2O4)和浓硫酸加热制取一氧化碳的气体发生装置,反应
的化学方程式是:H2C2O4 ="=====" H2O+CO2↑+CO↑(条件略)。请回答下列问题:
(1)B装置中氢氧化钠溶液的作用是.
(2)C装置无明显现象,C装置的作用是。
D装置中浓硫酸的作用是。
(3)E装置中发生反应的化学方程式。
(4)F装置的作用是、。
兴趣小组同学为了探究实验室中久置的氢氧化钠固体的成分,进行了有关实验。请你与他们一起完成以下探究活动:
【对固体猜想】
猜想Ⅰ:全部是NaOH;猜想Ⅱ:全部是Na2CO3;猜想Ⅲ:是NaOH和Na2CO3混合物。
【实验和推断】
(1)若现象a为有气泡产生,则加入的A溶液是,说明氢氧化钠已经变质,有气泡产生的反应的化学方程式是。
(2)若A是Ca(OH)2溶液,现象a有白色沉淀,现象b为无色酚酞试液变红色,则白色沉淀为(填化学式),该实验(填“能”或“不能”)说明样品中有NaOH。
(3)若A是CaCl2溶液,当实验现象a为,现象b为,则猜想Ⅱ成立。
同学们在探究碱溶液与酚酞溶液作用的实验时,发现了一个意外现象:向氢氧化钠溶液中滴入酚酞溶液(如图),溶液变成了红色,但是一会儿红色就消失了。为此某化学小组的同学进行了如下探究。
【提出猜想】甲:可能是酚酞溶液变质的缘故
乙:可能是氢氧化钠溶液与空气中二氧化碳反应的缘故
丙:可能是氢氧化钠与酚酞混合后与空气中氧气反应,使红色消失的缘故
丁:可能与氢氧化钠溶液的质量分数有关
【查阅资料】酚酞是一种常用酸碱指示剂,遇碱性溶液变红。
【讨论分析】(1)甲同学提出猜想后,很快被小组同学否定了,其理由是若酚酞试剂变质,就不可能出现遇氢氧化钠溶液变红的现象。
(2)经过认真思考,大家认为乙同学的猜想也不正确,其理由是。
【实验设计】(3)为验证丙同学的猜想是否正确,小组同学做了如下实验,请完成表中内容。
| 实验步骤 |
实验目的 |
现象结论 |
| ①用煮沸过的蒸馏水配制某氢氧化钠溶液。 |
溶液先变成红色,一会儿红色又消失。 丙同学的猜想不正确。 |
|
| ②取少量上述氢氧化钠溶液,滴入酚酞,然后在上方滴一些植物油。 |
【实验方法】(4)为验证丁同学的猜想是否正确,小组同学进行了如下实验探究,请回答有关问题。
方案一:分别配制不同质量分数的氢氧化钠溶液,然后各取少量并滴加2滴酚酞溶液。
现象和结论: 质量分数小的溶液中红色不消失,质量分数大的溶液中红色会消失,则证明
方案二:
现象和结论:出现红色且不褪去,结论同上。
下图为某同学设计的一个趣味实验,装置气密性良好。他把铝屑加入到盛有稀硫酸的锥形瓶中,整个实验过程如图所示。
(1) 写出A中发生反应的方程式
(2) 待锥形瓶冷却到室温,气球膨胀(如图B所示)。请用理化知识解释气球膨胀的原因.
某化学兴趣活动小组的同学学习“灭火器原理”后,设计了如下图所示实验,并对反应后锥形瓶中残留废液进行探究。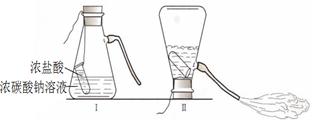
【提出问题】废液中所含溶质是什么物质?
【猜想与假设】
猜想1:废液中的溶质可能是NaCl、Na2CO3和HCl。
猜想2:废液中的溶质只有NaCl。
猜想3:废液中的溶质是NaCl和HCl。
猜想4:废液中的溶质是__________________。
【讨论与交流】
小明认为猜想1无需验证就知道是错误的。他的理由是___。
【实验与结论】
(1)为验证猜想2,小强同学取少量废液装入试管中,然后滴入AgNO3溶液,产生白色沉淀,滴加稀硝酸沉淀不溶解。于是小强认为猜想2正确。小强的实验______(填“能”或“不能”)验证猜想2的正确性,原因是_____________________。
(2)小丽为验证猜想3,选锌粒做试剂。若猜想3是正确的,验证时反应的化学方程式为_____________________________________________。
(3)若验证猜想4是否正确,下列试剂中可选用的有____________(填序号)。
①氢氧化钠溶液②氯化钙溶液③稀盐酸④氯化钾溶液
【拓展与应用】
若废液中的溶质是NaCl和HCl,根据HCl的性质,无需另加试剂,只要对废液进行_______________操作即可从废液中得到NaCl固体。此方法的缺点是_______________________________________________。