下列叙述正确的是
| A.苯中含有少量苯酚,可先加适量的浓溴水,使苯酚生成三溴苯酚,再过滤而除去 |
| B.将苯酚晶体放入少量水中,加热时全部溶解,冷却到50℃形成悬浊液 |
| C.苯酚的酸性很弱,不能使酚酞指示剂变色,但可以和碳酸氢钠反应生成二氧化碳 |
D.苯酚有毒,但其稀溶液 可直接用作防腐剂和消毒剂 可直接用作防腐剂和消毒剂 |
①pH=2的CH3COOH溶液;②pH=2的HCl溶液;③pH=12的氨水;④pH=12的NaOH溶液。相同条件下,有关上述溶液的比较中,不正确的是()
| A.水电离的c(H+):①=②=③=④ |
| B.若将②、③溶液混合后,pH=7,则消耗溶液的体积:②>③ |
| C.等体积的①、②溶液分别与足量铝粉反应,生成H2的量:②最大 |
| D.向溶液中加入100mL水后,溶液的pH:③>④>②>① |
在下列有FeCl3溶液参加的反应中,与Fe3+水解有关的反应是
①FeCl3溶液与Cu的反应②将FeCl3溶液加热蒸干,并灼烧最终得到Fe2O3③饱和FeCl3溶液滴入沸水中制备Fe(OH)3胶体④配制FeCl3溶液需加入一定量的盐酸
| A.①④ | B.②③④ | C.②③ | D.①②③④ |
不能说明CH3COOH是弱酸的事实是
| A.醋酸钠溶液显碱性 |
B.10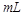 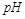 =2的醋酸溶液加水稀释到100 =2的醋酸溶液加水稀释到100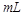 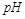 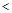 3 3 |
C.中和10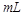 0.1 0.1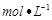 醋酸溶液,需要消耗0.1 醋酸溶液,需要消耗0.1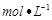 氢氧化钠溶液10 氢氧化钠溶液10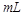 |
| D.0.1 mol·L-1的醋酸溶液中,氢离子浓度约为0.001 mol·L-1 |
下列离子方程式书写正确的是
A.NaHS水解反应:HS-+ H2O   H3O++ S2- H3O++ S2- |
B.明矾加入在水中起净化作用的原因:Al3++ 3H2O 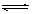 Al(OH)3(胶体) + 3H+ Al(OH)3(胶体) + 3H+ |
C.氢氧化钡溶液与稀硫酸反应:Ba2++SO 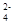 +H++OH-===BaSO4↓+H2O +H++OH-===BaSO4↓+H2O |
| D.碳酸氢钠溶液中加入过量Ba(OH)2溶液: |
2HCO3- + Ba2+ + 2OH-= BaCO3↓+ CO32-+ 2H2O
关于强、弱电解质的叙述不正确的是( )
| A.强电解质在溶液中完全电离成阴、阳离子 |
| B.强电解质溶液导电能力不一定比弱电解质溶液导电能力强 |
| C.同一弱电解质同浓度的溶液,温度不同时,导电能力不同 |
| D.强电解质易溶于水,弱电解质一定难溶于水 |