锑(Sb)在自然界一般以硫化物的形式存在,我国锑的蕴藏量占世界第一。从硫化物中提取单质锑一般是先在高温下将硫化物转化为氧化物,再用碳还原:
① 2Sb2S3+3O2+6Fe=Sb4O6+6FeS ②Sb4O6+6C=4Sb+6CO。关于反应①、②的说法正确的是
A.反应①②中的氧化剂分别是Sb2S 3、Sb4O6 3、Sb4O6 |
| B.反应①中每生成3 mol FeS时,共转移6 mol电子 |
| C.反应②说明高温下Sb的还原性比C强 |
| D.每生成4 mol Sb时,反应①与反应②中还原剂的物质的量之比为4︰3 |
.将a g无水Na2CO3溶于t℃的饱和Na2CO3溶液中,析出b g晶体,则(b-a) g表示的含义是()
| A.减少的饱和溶液的质量 | B.饱和溶液失去溶质Na2CO3的质量 |
| C.析出Na2CO3·10H2O的质量 | D.饱和溶液失去水的质量 |
下列离子方程式书写正确的是()
| A.过量的CO2通入Ca(ClO)2溶液中 2ClO-+CO2+H2O=CO32-+2HClO |
| B.AgNO3溶液滴入少量的Na2S溶液 2Ag++S2-=Ag2S↓ |
| C.向Na2CO3溶液中加入过量CH3COOH溶液 CO32-+2H+=CO2↑+H2O |
| D.向Ba(OH)2溶液中加入少量的NaHSO3溶液 |
2HSO3-+Ba2++2OH-=BaSO3↓+SO32-+2H2O
关于下列各装置图的叙述中,正确的是()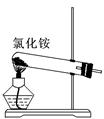



① ② ③ ④
| A.实验室用装置①制取氨气 |
| B.装置②中X若为四氯化碳,可用于吸收氨气,并防止倒吸 |
| C.装置③可用于制备氢氧化亚铁并观察其颜色 |
| D.装置④是原电池,锌电极为负极,发生还原反应 |
取少量无机盐溶液试样对其中的离子进行检验。下列判断正确的是()
| A.加入盐酸,产生白色沉淀,则试样中一定有Ag+ |
| B.加入盐酸,产生能使澄清石灰水变浑浊的无色气体,则试样中一定有CO32-[ ] |
| C.加入BaCl2溶液,产生白色沉淀,再加入稀硝酸,沉淀不溶解,则试样中一定有SO42 |
| D.加入NaOH溶液微热,产生能使湿润的红色石蕊试纸变蓝的气体,则试样中一定有NH4+ |
在含有FeCl3和BaCl2的酸性溶液中,通入足量的SO2后有白色沉淀生成,过滤后,向溶液中滴加KSCN溶液,无明显现象,下列叙述正确的是()
| A.白色沉淀是BaSO4和BaSO3 | B.溶液的酸性减弱 |
| C.白色沉淀是BaSO3 | D.FeCl3全部被还原为FeCl2 |