在花瓶中加入“鲜花保鲜剂”,能延长鲜花的寿命。下表是500ml“鲜花保鲜剂”中含有的成分,阅读后回 答下列问题:
答下列问题:
| 成分 |
质量(g) |
摩尔质量(g ·mol-1) |
| 蔗糖 |
25.00 |
342 |
| 硫酸钾 |
0.87 |
174 |
| 阿司匹林 |
0.17 |
180 |
| 高锰酸钾 |
 0.316 0.316 |
158 |
| 硝酸银 |
0.02 |
170 |
(1)下列“鲜花保鲜剂”的成分中,属于非电解质的是________。
A.蔗糖 B.硫酸钾 C.高锰酸钾 D.硝酸银
(2)配制上述“鲜花保鲜剂”所需的仪器有:天平、烧杯、药匙、______________、______________、_______________。(在横线上填写所缺仪器的名称)
(3)在溶液配制过程中,下列操作对配制结果没有影响的是___________。
A.定容时俯视容量瓶刻度线
B.容量瓶在使用前未干燥,里面有少量蒸馏水
C.容量瓶在使用前刚刚配制完一定物质的量浓度的NaCl溶液而未洗净
D.定容摇匀后发现液面低于容量瓶的刻度线,但未做任何处理
(4)“鲜花保鲜剂”中K+(阿司匹林中不含K+)的物质的量浓度为_______mol/L。
军事上的“地表伪装”是使军事保护的外观色彩、红外反射与环境吻合。BASF是在20世纪70年代开发的苝系新型红外伪装还原染料,该染料为橄榄色或黑色。其化学结构为: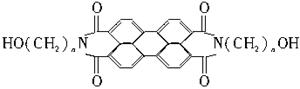
请完成下列问题:
(1)染料BASF的分子式可表示为C2n+24HxN2O6,则x=_________。
(2)1 mol该物质与Na反应产生氢气的量及在催化剂作用下加成所需氢气的量,其最大值(物质的量)分别为_________、_________。
(3)当n=3时,其中碳原子上的一氯取代物可能有_________种。
A是一种含碳、氢、氧三种元素的有机化合物。已知:A中碳的质量分数为44.1%,氢的质量分数为8.82%;A只含一种官能团,且每个碳原子上最多只连一个官能团;A能与乙酸发生酯化反应,但不能在两个相邻碳原子上发生消去反应。请填空:
(1)A的分子式是__________________,其结构简式是__________________。
(2)写出所有满足下列3个条件的A的同分异构体的结构简式:①属直链化合物;②与A具有相同的官能团;③每个碳原子上最多只连一个官能团。这些同分异构体的结构简式是________________________________________________________________________。
某有机化合物A的相对分子质量大于110,小于150。经分析得知,其中碳和氢的质量分数之和为52.24%,其余为氧。请回答:
(1)该化合物分子中含有几个氧原子,为什么?
(2)该化合物的相对分子质量是___________________。
(3)该化合物的化学式(分子式)是__________________。
(4)该化合物分子中最多含_________个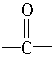 官能团。
官能团。
通常,烷烃可以由相应的烯烃经催化加氢得到。有一种烷烃A,分子式是C9H20,它却不能由任何C9H18的烯烃催化加氢得到;而另有A的三个同分异构体B、C、D,却分别可由而且只能由1种相应的烯烃催化加氢得到。A及另外三种同分异构体的结构简式分别是:_______________、_________________、________________、_______________。
吗啡和海洛因都是严格查禁的毒品,吗啡分子中C、H、N的质量分数依次为715.8%、6.67%、4.91%,其余为氧。
(1)写出吗啡的化学式:________________________,并计算其相对分子质量(已知吗啡的相对分子质量不超过300):_________。
(2)已知海洛因是吗啡的二乙酸酯,则海洛因的相对分子质量为_________,化学式为__________________。