物质的量浓度相同的NaCl、MgCl2、AlCl3三种溶液,当溶液的体积比为3:2:1时,三种溶液中Cl-的物质的量浓度之比为( )
| A.1:1:1 | B.1:2:3 | C.3:2:1 | D.3:4:3 |
在进行蒸馏操作中,加热一段时间后,发现碎瓷片忘加,应采取的正确操作是
| A.立即补加 | B.冷却后补加 | C.不需补加 | D.重新配料 |
下列物质中,不属于电解质的是
| A.H2SO4 | B.AgCl | C.NaOH | D.酒精 |
下列各选项所描述的两个量,前者一定大于后者的是
| A.纯水在25℃和80℃时的pH值 |
| B.25℃时,pH=3的盐酸和AlCl3溶液中,水电离的氢离子的浓度 |
| C.耐火材料CaO和MgO的熔点 |
| D.1L pH = 2的盐酸和醋酸溶液中,分别投入足量锌粒,放出H2的物质的量 |
将溶液(或气体)X逐渐加入(或通入)到一定量Y溶液中,产生沉淀的质量与加入X的物质的量关系如图,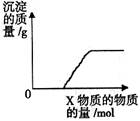
符合图中情况的一组物质是
| A |
B |
C |
D |
|
| X |
Ba(HCO3)2溶液 |
Na2CO3溶液 |
KOH溶液 |
CO2气体 |
| Y |
NaOH溶液 |
CaCl2溶液 |
Mg(HSO4)2溶液 |
石灰水 |
设NA表示阿伏加德罗常数,下列叙述中正确的是:
| A.在25℃,1.01×105Pa时,11.2L氮气所含的原子数目为NA |
| B.48g O3和O2混合气体所含的原子数目为3NA |
| C.1mol氦气所含的电子数目为4NA |
| D.2.7g金属铝变成铝离子时失去的电子数目为0.1NA |