小红同学想探究实验室中碳酸钙和盐酸制取二氧化碳后废液中溶质的成分,请你一同参与探究并回答横线上的①~⑦七个问题。
【提出问题】废液中的溶质是什么物质?
【作出猜想】小红认为废液中溶质只有
。
你认为还可能含有的溶质是(填化学式)。
【查阅资料】
溶液呈中性。
【实验与结论】
(1)请你写出实验室制取二氧化碳的化学方程式。
(2)分别取少量该废液和CaCl2溶液加入到两支试管中,并向其中分别滴入无色酚酞试液做对比试验,结果两支试管中溶液均无色,于是小红认为自己的猜想是正确的。
(3)你认为小红的实验填"能"或"不能")证明她的猜想,理由是。
(4)如果要证明你的猜想是正确的,你选择(填字母:A、石蕊试液 B、氢氧化钠溶液 C、 稀盐酸 )来代替酚酞试液,理由是。
(5)若实验证明了你的猜想是正确的,向废液中加入过量的 ,反应完成后过滤就可得到只含
一种溶质的溶液。
下列装置常用于实验室制取气体。根据给出的装置回答下列问题:
(1)指出编号仪器名称:①,②。
(2)利用C装置收集氧气的最佳时刻是。
用收集到的氧气完成硫粉燃烧实验后,还需向集气瓶内加入适量氢氧化钠溶液,目的是:(用化学方程式表示)。
(3)制取并收集二氧化碳应选择的装置是(从A——E中选择),若改用F装置收集二氧化碳,则气体应从端进入。
(4)将纯净的二氧化碳气体通入盛有蒸馏水的洗气瓶一段时间后,测得该装置中溶液的pH(填“>”、“<”或“=”)7。
小刚在化学实验室发现,盛放NaOH溶液的试剂瓶瓶口和橡皮塞上出现了白色粉末。小刚叫来小军和小红,共同探究这种白色粉末的成分。他们依据所学的化学知识,对这种白色粉末的成分作了如下猜想:
【提出猜想】①可能是NaOH;② 可能是Na2CO3; ③ 可能是。
【实验探究】他们分别做了下面的实验。
(1)小军取少量白色粉末溶于水,向所得溶液中滴加酚酞试液,溶液变为红色。由此小军认为白色粉末是NaOH。请判断小刚所得结论是否正确,_______(填“正确”或“不正确”),并简述理由:
____________________________________________________________________。
(2)小红取少量白色粉末溶于水,向所得溶液中滴加BaCl2试液,有白色沉淀产生。由此判断白色粉末中含有______。为了验证猜想③,小红继续向溶液中滴加BaCl2试液至不再产生沉淀,然后过滤。你认为她接下来还应进行的实验是 。
【实验反思】在小红所做的实验中,若把BaCl2溶液换成Ba(OH)2溶液是否可行?________(填“是”或“否”),请简述理由。_______________________________________________________。
一次,小刚在实验室看到了右图情景: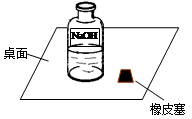
他首先想到药品可能变质了,那么NaOH溶液在空气中变质的化学方程式为______________________________________;
小刚利用实验室的三种试剂(氯化钙溶液、稀盐酸、酚酞试剂)对这瓶“NaOH溶液”展开了探究。
[提出猜想]
猜想①:氢氧化钠溶液没有变质
猜想②:____________________
猜想③:氢氧化钠溶液完全变质
[实验探究]
| 方案 |
现象 |
结论 |
|
| I |
取少量溶液于试管中,滴入足量__________试剂 |
产生大量气泡 |
猜想①不成立 |
| II |
取少量溶液于试管中,滴加酚酞试剂 |
溶液变红 |
溶液中一定含NaOH |
| III |
a.取少量溶液于试管中,滴加足量________试剂; |
____________ |
猜想②成立 |
| b.向a中所得溶液中滴加酚酞 |
溶液变红 |
经过思考,小刚否定了方案II的结论,理由是______________________________。
[反思评价]氢氧化钠溶液暴露在空气中容易变质,故应____________保存。
探究二:精还原铁粉是一种重要的化工原料,某兴趣小组对其进行下列研究:
【物质制备】利用绿矾制备精还原铁粉的工艺流程如下: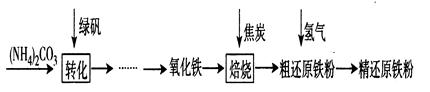
粗还原铁粉中还含有少量铁的氧化物和Fe3C杂质,可用氢气在高温下进一步还原,其反应方程式为FexOy + y H2 x Fe + y H2O,Fe3C + 2 H2
x Fe + y H2O,Fe3C + 2 H2 3 Fe + CH4。
3 Fe + CH4。
(1)写出焙烧中氧化铁与CO反应的化学方程式:。
(2)焙烧中加焦炭的作用除了可以生成CO外,还能。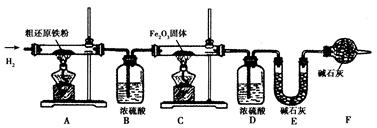
【含量测定】为得到精还原铁粉并测定粗还原铁粉中氧和碳元素的质量分数,按如下装置进行实验。已知3 CH4 + 4 Fe2O3 3 CO2 + 6H2O + 8 Fe(假设每步反应都完全,且不考虑装置内原有空气对测定结果的影响)。
3 CO2 + 6H2O + 8 Fe(假设每步反应都完全,且不考虑装置内原有空气对测定结果的影响)。
(3)主要实验步骤如下:
①按顺序组装仪器,检查装置的气密性,称量样品和必要装置的质量;②点燃A处酒精灯;③缓缓通入纯净干燥的H2;④点燃C处酒精灯;⑤分别熄灭A处、C处酒精灯;⑥再缓缓通入少量H2;⑦再次称量必要装置的质量。
操作的先后顺序是①→③→→⑤→⑥→⑦(填字母)
A.②→④B.④→②
(4)步骤③的目的是,验证该步骤目的达到的实验方法是;
(5)若缺少装置D,则所测氧元素的质量分数将(填“偏大’’“偏小"或“不变")。
(6)粗还原铁粉样品的质量为20.000 g,装置B、E分别增重0.360 g和0.440 g,则计算样品出中碳元素的质量分数是,氧元素的质量分数是。
探究一:工业铁红的主要成分是Fe2O3,还含有少量的FeO、Fe3O4。某兴趣小组用草酸晶体制取CO,并进行了如下图所示实验。试回答:
【查阅资料】草酸晶体(H2C2O4·3H2O)在浓H2SO4作用下受热分解生成CO2和CO。
(1)实验前应先。
(2)进入D中的气体是纯净、干燥的CO,则A中试剂是、C中的试剂是(填字母编号)。
a.浓硫酸b.澄清的石灰水c.氢氧化钠溶液
(3)F装置的作用是。
(4)某同学认为图示装置有不足之处,改进的方法是。