探究一:工业铁红的主要成分是Fe2O3,还含有少量的FeO、Fe3O4。某兴趣小组用草酸晶体制取CO,并进行了如下图所示实验。试回答:
【查阅资料】草酸晶体(H2C2O4·3H2O)在浓H2SO4作用下受热分解生成CO2和CO。
(1)实验前应先 。
(2)进入D中的气体是纯净、干燥的CO,则A中试剂是 、C中的试剂是 (填字母编号)。
a.浓硫酸 b.澄清的石灰水 c.氢氧化钠溶液
(3)F装置的作用是 。
(4)某同学认为图示装置有不足之处,改进的方法是 。
草酸(H2C2O4)是一种有机酸,其晶体(C2H2O4·2H2O)是一种无色晶体,熔点较低,加热会熔化、气化和分解。草酸晶体受热分解生成碳的氧化物和水。
某化学课外兴趣小组对草酸晶体受热分解进行了以下探究实验。
【提出问题】如何通过实验确定碳的氧化物的成分。
【猜想】
| 猜想1 |
猜想2 |
猜想3 |
| 只有CO |
只有 |
CO、CO2都有 |
【设计实验】基于猜想3,兴趣小组同学设计了如下实验装置:
【实验探究】
(1)实验过程中观察到 装置(填字母)中的澄清石灰水变浑浊,证明有CO2气体。
(2)实验过程中还观察到以下实验现象:①C装置中澄清石灰水不变浑浊;②E装置中 ;③F装置中澄清石灰水变浑浊,证明有CO气体。
【实验结论】通过实验探究证明:猜想3成立。
草酸分解的化学方程式是 。
【问题讨论】
(1)C装置的作用是 ;D装置的作用是 。
(2)装置末端酒精灯的作用是 。
【实验反思】
(1)如图G是用来加热草酸晶体的装置。请写出标号仪器的名称① ;② 。
小华认为该装置错误,正确的应是试管口略向下倾斜,你认为小华的判断 (选填:“正确”或“不正确”),理由是 。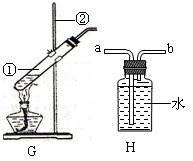
(2)实验室也可用加热草酸晶体的方法获得CO。CO是一种无色、无味的剧毒气体,其密度比空气略小,难溶于水。CO使人体中毒的原因是 ;收集CO可用H装置,气体应从 端进入(选填“a”或“b”)
某研究性学习小组对中和反应进行探究,请你参与实验:
实验1:证明酸和碱发生了反应
稀盐酸和NaOH溶液混合没有明显现象,小丽同学按图1进行实验,证明了盐酸和
NaOH溶液发生化学反应,他依据的实验现象是 。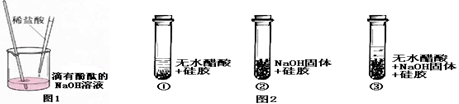
实验2:证明酸和碱反应有水生成
小明同学取变色硅胶(吸水后由蓝色变红色)、无水醋酸(一种酸,常温下为无色液体)和氢氧化钠固体进行图2所示的三个实验。
(1)加入试剂后,要迅速塞紧橡胶塞的目的是 。
(2)能证明酸和碱反应有水生成,依据的现象是 。
实验3测量酸和碱反应过程的pH
(1)实验过程中用传感器实时获得溶液的pH,要得到右图所得变化曲线,所进行
的操作是 (填字母)。
A.将盐酸溶液逐滴滴加到氢氧化钠溶液中
B.将氢氧化钠溶液爱滴滴加到盐酸溶液中
(2)0—t1时,溶液的酸碱性变化情况是_________________。
(3)根据下图溶液pH的变化,判断酸和碱发生反应的依据是________________。
如图所示,某兴趣小组同学在进行酸碱中和反应的实验时,向烧杯中的氢氧化钠溶液滴加稀硫酸,一会儿发现由于忘记了滴加酚酞指示剂,因而无法确定稀硫酸与氢氧化钠是否恰好完全反应.
小明说:溶质只有硫酸钠;小刚说:溶质除了硫酸钠外还有硫酸;小丽想了想,觉得还有另外一种可能:除了硫酸钠外还有.
为了证明大家的猜想,小明从烧杯中取出少量反应后的溶液于一支试管中,并向试管中滴加几滴无色酚酞试液,振荡,观察到酚酞试液不变色.于是小明和小刚说小丽的猜想是不正确.
(1)你认为小明和小刚得出的结论是否正确(填“是”或“否”),理由是;
(2)为了进一步探究小明和小刚的猜想哪个正确,请你设计实验来证明.(写出实验步骤、现象和结论).
(3)关于实验中的细节和意外情况:
①实验中,常常滴加酚酞溶液而不用石蕊溶液的原因
②实验过程中,要用玻璃棒不断搅拌,这样做的目的是
钛(Ti)是一种重要的航天金属材料.某学习小组对三种金属Ti、Al、Cu的金属活动性顺序进行探究.过程如下:
提出假设:a.Ti金属活动性比Al强 b.Al金属活动性比Cu强
查阅资料:钛能与盐酸反应.
实验设计:同温下,取大小相同的这三种金属薄片,分别投入等体积等浓度的足量的稀盐酸中反应,观察现象.
操作分析:三种金属加入盐酸前都先用砂布将表面擦光亮,其目的是
A.除去氧化膜,利于直接反应
B.使表面光亮,易观察现象
C.使反应金属温度相同,易反应
| 金属 |
Ti |
Al |
Cu |
| 与盐酸反应现象 |
反应缓慢 |
反应剧烈 |
无明显现象 |
实验现象,实验结论:
(1)原假设中不正确(填“a”、“b”或“a、b”).
(2)三种金属的金属活动性由强至弱的顺序为。
结论应用:能否用铝制容器来盛装波尔多液(含硫酸铜),(填“能”或“否”),理由是。
过氧化钠是化学中常见的一种药品,它是浅黄白色颗粒粉末.在空气中吸收水分和二氧化碳。易溶于水,与水中能发生反应生成氢氧化钠和过氧化氢,方程式:Na2O2+2H2O=2NaOH+H2O2,过氧化氢又能分解放出氧气。
(1)区分水和过氧化氢的实验方法是:,发生的反应方程式是:.
(2)某同学为了证明过氧化钠加入水中生成了氢氧化钠,在生成的溶液中滴加了几滴无色酚酞试液,观察到的现象是溶液先变红后褪为无色,请你对此现象进行探究.
提出问题:什么导致溶液先变红再褪色?
猜想与假设:
猜想1:甲同学“可能是无色酚酞溶液变质导致溶液褪色”;
猜想2:乙同学“可能是生成的过氧化氢使溶液褪色”.
实验与结论:
a:甲同学提出的猜想,立即遭到其他同学的反对,因为;
b:为了验证自己的猜想,乙同学设计了以下方案并实验验证:
| 实验步骤 |
实验现象 |
实验结论 |
| 取少量稀氢氧化钠溶液于试管中,滴加1﹣2滴酚酞试液,变红后观察现象 |
溶液依然为红色 |
讨论交流:你还能提出不同的猜想吗?如果还能提出新的合理的假设和方案你将获得奖励分4分.(化学试卷总分不超过60分)
猜想3:
方案3:
| 实验步骤 |
实验现象 |
实验结论 |