某溶液中可能含有H+、Na+、NH4+、Mg2+、Fe3+、Al3+、SO42-离子,当向该溶液加入某浓度的NaOH溶液时,发现生成沉淀的物质的量 随NaOH溶液的体积变化如图所示,
随NaOH溶液的体积变化如图所示,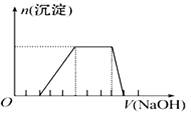
由此可知,该溶液中肯定含有的阳离子是_______________________,且各离子的物质的量之比为_____ ;肯定不含的阳离子是_____________ 。
已知下列热化学方程式:①2H2(g) +O2(g)=2H2O(l);ΔH= -570 kJ·mol-1
②2H2(g) +O2(g)=2H2O(g) ΔH= -483.68 kJ·mol-1
③2C(s) +O2(g)=2CO(g) ΔH=-221 kJ·mol-1
④ C(s) +O2(g)=CO2(g) ΔH= -393.5 kJ·mol-1
回答下列问题:
(1)H2的燃烧热为;C的燃烧热为。
(2)燃烧10gH2生成液态水,放出的热量为。
(3)写出CO燃烧的热化学方程式。
(4分)根据下列叙述写出相应的热化学方程式:
(1)已知16 g固体硫完全燃烧时放出148.4 kJ的热量,该反应燃烧的热化学方程式是
____________________________________________________
(2)如图是298 K时N2与H2反应过程中能量变化的曲线图。该反应的热化学方程式为:_________________________________。
芳香化合物A、B互为同分异构体,B的结构简式是CH3COO- -COOCH2CH3
-COOCH2CH3
A经①、②两步反应得C、D和E,B经①、②两步反应得E、F和H。上述反应过程、产物性质及相互关系如下图所示: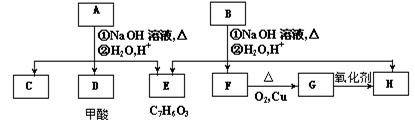
(1)B可以发生的反应类型有(填序号)。
①加成反应②酯化反应③消去反应④取代反应⑤聚合反应
B的核磁共振氢谱中会出现_______个峰。
(2)E中含有官能团的名称是。
(3)A有两种可能的结构,其对应的结构简式为,。
(4)B、C、D、F、G化合物中互为同系物的是。
(5)F与H在浓硫酸作用下加热时发生反应的方程式为。
砷(As)在地壳中含量不大,但砷的化合物却是丰富多彩。
(1)基态砷原子的电子排布式为;砷与溴的第一电离能较大的是。
(2)AsH3是无色稍有大蒜味气体。AsH3的沸点高于PH3,其主要原因是。
(3)Na3AsO4可作杀虫剂。AsO43-的空间构型为,与其互为等电子体的一种分子为。
(4)某砷的氧化物俗称“砒霜”,其分子结构如图所示。该化合物的分子式为,As原子采取杂化。
(5)GaAs等是人工合成的新型半导体材料,其晶体结构与金刚石相似。GaAs晶体中,每个As与个Ga相连,As与Ga之间存在的化学键有(填字母)。
| A.离子键 | B.氢键 | C.配位键 | D.金属键 E.极性键 |
氨是一种重要的化工原料,氨的合成和应用是当前的重要研究内容之一。
(1)一定条件下,在一个密闭容器中充入气体:N2 2mol、H2 6mol,达平衡后N2的转化率为50%,同时放热92.3KJ。该反应的热化学方程式为:______________________________。
(2)传统哈伯法合成氨工艺中相关的反应式为:N2+3H2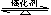 2NH3。
2NH3。
①该反应的平衡常数K的表达式为:K=______________。升高温度,K值______(填“增大”“减小”或“不变”)。
②不同温度、压强下,合成氨平衡体系中NH3的物质的量分数见下表(N2和H2的起始物质的量之比为1∶3)。分析表中数据,(填温度和压强)。时H2转化率最高,实际工业生产中不选用该条件的主要原因是。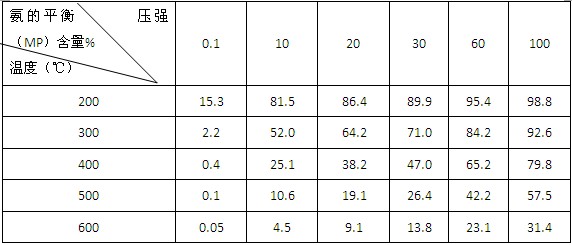
③下列关于合成氨说法正确是(填字母)
A.使用催化剂可以提高氮气的转化率
B.寻找常温下的合适催化剂是未来研究的方向
C.由于ΔH<0、ΔS>0,故合成氨反应一定能自发进行
(3)最近美国Simons等科学家发明了不必使氨先裂化为氢就可直接用于燃料电池的方法。其装置为用铂黑作为电极,加入电解质溶液中,一个电极通入空气,另一电极通入氨气。其电池反应为4NH3+3O2=2N2+6H2O,你认为电解质溶液应显性(填“酸性”、“中性"、“碱性”),写出负极电极反应式。
(4)工业上净化处理铬污染方法之一是:将含K2Cr2O7酸性废水放入电解槽内,加入适量的NaCl,以Fe和石墨为电极进行电解。经过一段时间后,生成Cr(OH)3和Fe(OH)3沉淀除去(已知Ksp[Fe(OH)3]=4.0×10-38,Ksp[Cr(OH)3]=6.0×10-31)。
已知电解后的溶液中c(Fe3+)为2.0×10-13mol/L,则溶液中c(Cr3+)为mol/L。