氨是一种重要的化工原料,氨的合成和应用是当前的重要研究内容之一。
(1)一定条件下,在一个密闭容器中充入气体:N2 2mol、H2 6mol,达平衡后N2的转化率为50%,同时放热92.3KJ。该反应的热化学方程式为:______________________________。
(2)传统哈伯法合成氨工艺中相关的反应式为:N2+3H2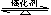 2NH3。
2NH3。
①该反应的平衡常数K的表达式为:K=______________。升高温度,K值______(填“增大”“减小”或“不变”)。
②不同温度、压强下,合成氨平衡体系中NH3的物质的量分数见下表(N2和H2的起始物质的量之比为1∶3)。分析表中数据, (填温度和压强)。时H2转化率最高,实际工业生产中不选用该条件的主要原因是 。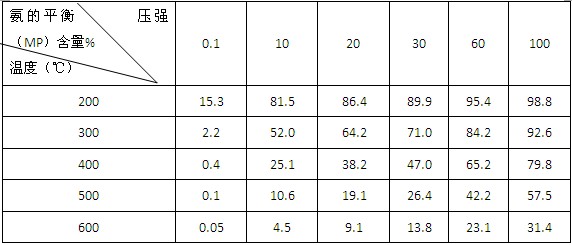
③下列关于合成氨说法正确是 (填字母)
A.使用催化剂可以提高氮气的转化率
B.寻找常温下的合适催化剂是未来研究的方向
C.由于ΔH<0、ΔS>0,故合成氨反应一定能自发进行
(3)最近美国Simons等科学家发明了不必使氨先裂化为氢就可直接用于燃料电池的方法。其装置为用铂黑作为电极,加入电解质溶液中,一个电极通入空气,另一电极通入氨气。其电池反应为4NH3+3O2=2N2+6H2O,你认为电解质溶液应显 性(填“酸性”、“中性"、“碱性”),写出负极电极反应式 。
(4)工业上净化处理铬污染方法之一是:将含K2Cr2O7酸性废水放入电解槽内,加入适量的NaCl,以Fe和石墨为电极进行电解。经过一段时间后,生成Cr(OH)3和Fe(OH)3沉淀除去(已知Ksp[Fe(OH)3]=4.0×10-38,Ksp[Cr(OH)3]=6.0×10-31)。
已知电解后的溶液中c(Fe3+)为2.0×10-13mol/L,则溶液中c(Cr3+)为 mol/L。
自然界中氮元素有多种存在形式。
(1)合成氨反应的化学方程式是_________________。
(2)NH3在一定条件下可被氧化.
已知:ⅰ.4NH3(g)+3O2(g)=2N2(g)+6H2O(g)△H=-1269kJ/mol
ⅱ.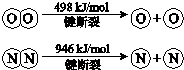
①断开1mol H-O 键与断开 1mol H-N 键所需能量相差约_________kJ;
(3)下图是某压强下,N2与H2按体积比1:3投料时,反应混合物中氨的体积分数随温度的变化曲线.其中一条是经过一定时间反应后的曲线,另一条是平衡时的曲线.
②H-O 键比H-N键(填“强”或“弱”)_____;
①图中b点,v(正)_____v(逆).(填“>”、“=”或“<”)
②图中a点,容器内气体n(N2):n(NH3)=_____。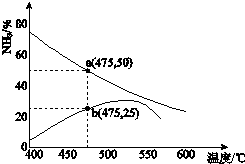
(4)水中的氨在微生物作用下可被氧化为亚硝酸,其化学方程式是_______________。
(5)电解法能将碱性溶液中的NO2-转化为N2而除去,其电极反应式是_______________。
Cl2及其化合物在生产、生活中具有广泛的用途。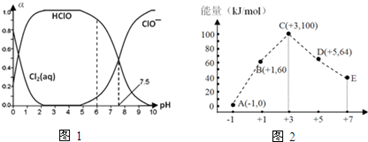
(1)25℃时将氯气溶于水形成氯气-氯水体系,该体系中Cl2(aq)、HClO和ClO-分别在三者中所占分数(α)随pH变化的关系如图1所示.
①已知HClO的杀菌能力比ClO-强,由图分析,用氯气处理饮用水时,pH=7.5与 pH=6时杀菌效果强的是_________________。
②氯气-氯水体系中,存在多个含氯元素的平衡关系,分别用平衡方程式表示为__________。
(2)ClO2是一种新的消毒剂,工业上可用Cl2氧化NaClO2溶液制取ClO2,写出该反应的化学方程式_________________。
(3)工业上还可用下列方法制备ClO2,在80℃时电解氯化钠溶液得到NaClO3,然后与盐酸反应得到ClO2.电解时,在______极(填阴或阳)生成,生成ClO3-的电极反应式为_________。
(4)一定条件下,在水溶液中 1mol Cl-、1mol ClOx-(x=1,2,3,4)的能量大小与化合价的关系如图2所示
①从能量角度看,C、D、E中最不稳定的离子是_________________(填离子符号)。
②B→A+D反应的热化学方程式为_________________(用离子符号表示)。
电解原理在化学工业中有广泛应用。如图表示一个电解池,装有电解液a,X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题: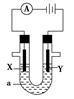
(1)若X、Y都是惰性电极,a是AgNO3溶液,实验开始时,同时在两边各滴入几滴石蕊试液,则:
①电解池中Y电极上的电极反应式为 ;在Y电极附近观察到的实验现象是 ;检验该电极反应产物的方法是 。
②X电极上的电极反应式为 。
(2)如要用电解方法精炼粗镍,电解液a选用Ni(NO3)2溶液,则:①X电极的材料是 ,电极反应式为 。
②Y极的材料是 ,电极反应式为 。
(说明:杂质发生的电极反应不必写出)。
某化学反应2A  B+D在四种不同条件下进行,B、D起始浓度为0。反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表:
B+D在四种不同条件下进行,B、D起始浓度为0。反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表:
| 实验 序号 |
时 间 浓度 温度 |
0 |
10 |
20 |
30 |
40 |
50 |
60 |
| 1 |
800℃ |
1.0 |
0.80 |
0.67 |
0.57 |
0.50 |
0.50 |
0.50 |
| 2 |
800℃ |
c2 |
0.60 |
0.50 |
0.50 |
0.50 |
0.50 |
0.50 |
| 3 |
800℃ |
c3 |
0.92 |
0.75 |
0.63 |
0.60 |
0.60 |
0.60 |
| 4 |
820℃ |
1.0 |
0.40 |
0.25 |
0.20 |
0.20 |
0.20 |
0.20 |
根据上述数据,完成下列填空:
(1)在实验1,反应在10至20分钟时间内平均速率为 mol/(L·min)。
(2)在实验2,A的初始浓度c2=____________mol/L,反应经20分钟就达到平衡,可推测实验2中还隐含的条件是___________。
(3)设实验3的反应速率为v3,实验1的反应速率为v1,则v3_______v1(填>、=、<),且c3_______1.0 mol/L(填>、=、<)。
(4)比较实验4和实验1,可推测该反应是________反应(选填吸热、放热)。理由是
现有可逆反应2NO2(g) N2O4(g),△H<0,试根据下列图象判断t2、t3、t4时刻采取的措(只改变一种外部条件)。
N2O4(g),△H<0,试根据下列图象判断t2、t3、t4时刻采取的措(只改变一种外部条件)。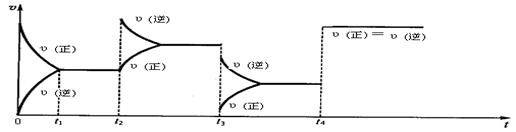
t2: ;t3: ;t4: 。
已知:A(g) + 2B(g) 2C(g) ΔH < 0。此反应的平衡常数表达式K=__________,温度降低,
2C(g) ΔH < 0。此反应的平衡常数表达式K=__________,温度降低,
K值会______(增大、减小、不变),A的转化率 ,化学反应速率 .。