下列各组烃的混合物,只要总质量一定,无论按什么比例混合,完全燃烧后生成的CO2和H2O都是恒量的是
| A.C2H2、C2H4 | B.C2H4、C4H6 | C.C3H8、C3H6 | D.C6H6、C2H2 |
下列各项与氧化还原反应无关的是
| A.明矾净化水 | B.燃烧 | C.臭氧消毒游泳池 | D.食物的腐败 |
清蒸大闸蟹由青色变成红色,一同学认为这种红色物质可能象酸碱指示剂一样,遇到酸或碱颜色会发生改变。就这位同学的看法而言,这应该属于科学探究中的
| A.实验 | B.假设 | C.观察 | D.分类 |
可以证明恒温恒容条件下可逆反应N2 + 3H2 2NH3已达到平衡状态的是
2NH3已达到平衡状态的是
①一个N≡N断裂的同时,有3个H-H键断裂
②一个N≡N键断裂的同时,有6个N-H键断裂
③混合气体平均相对分子质量不再改变
④体系压强不再改变
⑤NH3%、N2%、H2%都不再改变
⑥密度保持不变
⑦正反应速率v(H2) = 0.6mol/(L·min),逆反应速率v(NH3) = 0.4mol/(L·min)
| A.全部 | B.只有①③④⑤ | C.②③④⑤⑦ | D.只有③⑤⑥⑦ |
已知:H2(g)+I2(g) 2HI(g)△H < 0。有相同容积的定容密闭容器甲和乙,甲中加入H2和I2各0.1 mol,乙中加入HI 0.2 mol,相同温度下分别达到平衡。欲使甲中HI的平衡浓度大于乙中HI的平衡浓度,应采取的措施是
2HI(g)△H < 0。有相同容积的定容密闭容器甲和乙,甲中加入H2和I2各0.1 mol,乙中加入HI 0.2 mol,相同温度下分别达到平衡。欲使甲中HI的平衡浓度大于乙中HI的平衡浓度,应采取的措施是
| A.甲、乙提高相同温度 | B.甲中加入0.1 mol He,乙不变 |
| C.甲降低温度,乙不变 | D.甲增加0.1 mol H2,乙增加0.1 mol I2 |
已知:2CO(g)+O2(g)=2CO2(g) ΔH="-566" kJ/mol
Na2O2(s)+CO2(g)=Na2CO3(s)+1/2O2(g)ΔH="-226" kJ/mol
根据以上热化学方程式判断,下列说法正确的是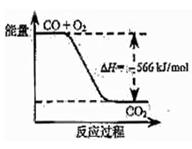
| A.CO的燃烧热为283 kJ |
| B.右图可表示由CO生成CO2的反应过程和能量关系 |
| C.2Na2O2(s)+2CO2(s)=2Na2CO3(s)+O2(g) ΔH>-452 kJ/mol |
| D.CO(g)与Na2O2(s)反应放出509 kJ热量时,电子转移数为6.02×1023 |