某温度(t℃)时,水的离子积为KW=1×10-13,则该温度(填“大于”、“小于”或“等于”)________25℃。若将此温度下pH=11的苛性钠溶液a L与pH=1的稀硫酸b L混合(设混合后溶液体积的微小变化忽略不计),试通过计算填写以下不同情况时两种溶液的体积比:
①若所得混合液为中性,则a∶b=________;此溶液中各种离子的浓度由大到小排列顺序是________________ 。
②若所得混合液的pH=2,则a∶b=________。此溶液中各种离子的浓度由大到小排列顺序是_______ _。
以下是依据一定的分类标准,对某些物质与水反应的情况进行分类的分类图。请根据你所学的知识,按要求填空:
(1)上述物质的分类方法是;
(2)根据物质与水反应的情况,分成A、B组的分类依据是(选择字母填空,下同),由A组分成C、D组的依据是(填字母)。
a.与水反应后溶液的酸碱性 b.与水反应的剧烈程度 c.是否发生氧化还原反应
(3)F组的物质是(填化学式)。
(4)A组中的酸性氧化物与B组中的某物质反应可用作呼吸面具或潜水艇中氧气的来源,其反应方程式为。
分析下列反应:5KCl + KClO3 + 3H2SO4 = 3Cl2↑+ 3K2SO4 + 3H2O,据此作答:
(1)标出该反应中电子的转移方向和数目:
5KCl + KClO3 + 3H2SO4 = 3Cl2↑+ 3K2SO4 + 3H2O
(2)该反应的氧化剂是。
(3)该反应的氧化产物与还原产物的质量比是。
(4)当反应生成0.3 mol Cl2时,则转移的电子的物质的量是。
还原铁粉是冶金工业的重要原料,利用绿矾制备还原铁粉的工业流程如下: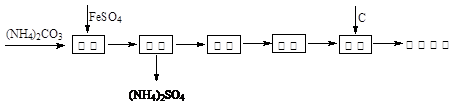
干燥过程主要是为了脱去游离水和结晶水,过程中会有少量FeCO3·nH2O被空气氧化为FeOOH,其化学方程式为。
取干燥后的FeCO3样品12.49 g焙烧至600℃,质量变为8.00 g。所得产物用CO还原可得到Fe 6.16g。则600℃产物的可能组成是________________________________________。
根据以上数据可计算FeCO3样品中FeCO3与FeOOH的质量。FeCO3的质量为_________, FeOOH的质量为________________。
有机物G(结构简式见图)也可用于合成奥沙拉秦。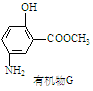 它的一种同分异构体X是
它的一种同分异构体X是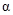 -氨基酸,能与FeCl3溶液发生显色反应。写出一种X可能的结构简式。
-氨基酸,能与FeCl3溶液发生显色反应。写出一种X可能的结构简式。
奥沙拉秦是一种抗菌药。其合成路线如下:
已知: ①NaNO2具有强氧化性
②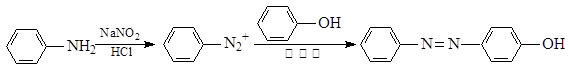
水杨酸中所含官能团的名称是。
A的分子式是。
B→C的化学方程式。
整个合成路线看,设计B→C步骤的作用是。
D的结构简式是。D→E的反应类型是。