还原铁粉是冶金工业的重要原料,利用绿矾制备还原铁粉的工业流程如下: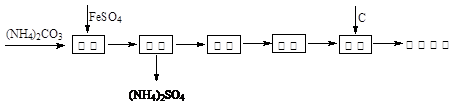
干燥过程主要是为了脱去游离水和结晶水,过程中会有少量FeCO3·nH2O被空气氧化为FeOOH,其化学方程式为 。
取干燥后的FeCO3样品12.49 g焙烧至600℃,质量变为8.00 g。所得产物用CO还原可得到Fe 6.16g。则600℃产物的可能组成是________________________________________。
根据以上数据可计算FeCO3样品中FeCO3与FeOOH的质量。FeCO3的质量为_________, FeOOH的质量为________________。
在2L密闭容器中,800℃时反应2NO(g)+O2(g) 2NO2(g)体系中,n(NO)随时间的变化如表:
2NO2(g)体系中,n(NO)随时间的变化如表:
| 时间(s) |
0 |
1 |
2 |
3 |
4 |
5 |
| n(NO)/mol |
0.020 |
0.010 |
0.008 |
0.007 |
0.007 |
0.007 |
(1)写出该反应的平衡常数表达式:K=__________________________。
已知:K(300℃)>K(350℃),该反应是__________热反应(填“放”或“吸”)。
(2)上述反应达平衡时,NO的转化率=__________________。
(3)下图中表示NO2的变化的曲线是____________(选填字母,下同)。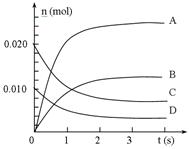
(4)能说明该反应已经达到平衡状态的是___________。
A.v(NO2)=2v(O2) B.容器内压强保持不变
C.v逆(NO)=2v正(O2) D.NO和NO2两物质的浓度相等
(5)为使该反应的反应速率增大,且平衡向正反应方向移动的是__________。
A.及时分离出NO2气体 B.适当升高温度
C.增大O2的浓度 D.选择高效的催化剂
固定和利用CO2能有效地利用资源,并减少空气中的温室气体.CO2与化合物A反应生成化合物B,如下反应式(其它试剂、产物及反应条件均省 略)。
略)。
(1)化合物B的分子式为__________,1 mol该物质完全燃烧需消耗_________mol O2。
(2)由 通过消去反应制备A的化学方程式为(注明反应条件):
通过消去反应制备A的化学方程式为(注明反应条件):
_______________________________________________________________________。
(3)B与过量C2H5OH在酸催化下发生酯化反应,生成的有机物的结构简式为:
__________________________________________。
(4)与CO2类似,CO也能被固定和利用。在一定条件下,CO、 和
和
H2三者发生反应(苯 环不参与反应),生成化合物C的分子式为C9H8O,且物质C能发生银镜反应。写出生成物C可能的结构简式:
环不参与反应),生成化合物C的分子式为C9H8O,且物质C能发生银镜反应。写出生成物C可能的结构简式:
___________________________________________________________________。
有机物A的结构简式为 ,该有机物A可通过不同化学反应分别制得下列B、C、D和E四种物质。
,该有机物A可通过不同化学反应分别制得下列B、C、D和E四种物质。
请回答下列问题:
(1)指出反应的类型:A → C。
(2)在A~E五种物质中,互为同分异构体的是(填代号)。
(3)写出由A生成B的化学方程式
。
(4)物质D结构中含有苯环、___________________________________等官能团。
(5)C能形成高聚物,该高聚物的结构简式为。
(6)写出D与NaOH溶液共热反应的化学方程式
。
将Al2O3和Fe2O3的混合物进行如下实验,试写出各步操作所发生反应的离子方程式:
①将混合粉末用硫酸充分溶解:
②在溶液中用过量浓氨水中和,得到沉淀:
③在沉 淀中滴加KOH溶液,充分反应滤出沉淀得:
淀中滴加KOH溶液,充分反应滤出沉淀得:
④往滤液中通入足量CO2:。
已知A、B、C为常见的单质,在一定条件下相互转化的关系如图:
(1)若常温 下,A、B均为气体,C为红
下,A、B均为气体,C为红 色固体,E为黑色固体,则E的化学式为__________,写出A + E →D的化学反应方程式__________________________。
色固体,E为黑色固体,则E的化学式为__________,写出A + E →D的化学反应方程式__________________________。
(2)若常温下B、C均为气体,A为金属单质,D为黑色晶体,则E的电子式为_____________,写出A + E → D的化学反应方程式_____________________。
(3)若常温下B为气体,C为黑色固体,则构成金属A的原子结构示意图为____________,写出A + E → D的化学反应方程式___________________________。