(15分)甲醇是一种可再生能源,具有广泛的开发和应用前景.请回答下列与甲醇有关的问题.
(1)甲醇分子是____________分子(填“极性”或“非极性”).
(2)工业上一般可采用如下反应来合成甲醇:CO(g)+2H2(g) 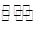 CH3OH(g)△H=﹣86.6KJ/mol,在T℃时,往一个体积固定为1L的密闭容器中加入1mol CO和2mol H2,反应达到平衡时,容器内的压强是开始时的3/5.
CH3OH(g)△H=﹣86.6KJ/mol,在T℃时,往一个体积固定为1L的密闭容器中加入1mol CO和2mol H2,反应达到平衡时,容器内的压强是开始时的3/5.
①达到平衡时,CO的转化率为____________
②下列选项能判断该反应达到平衡状态的依据的有____________
| A.2v(H2)=v(CH3OH) | B.CO的消耗速率等于CH3OH的生成速率 |
| C.容器内的压强保持不变 | D.混合气体的密度保持不变 |
E.混合气体的颜色保持不变 F.混合气体的平均相对分子质量不随时间而变化
(3)已知在常温常压下:
①2CH3OH(1)+3O2(g)=2CO2(g)+4H2O(g) △H=﹣akJ·mol﹣1
②2CO(g)+O2(g)=2CO2(g) △H=﹣bkl·mol﹣1
③H2O(g)=H2O(1) △H=﹣ckJ·mol﹣1
则CH3OH(1)+O2(g)==CO(g)+2H2O(1) △H=____________kJ·mol﹣1
(4)由甲醇、氧气和NaOH溶液构成的新型手机电池,可使手机连续使用一个月才充一次电.
①该电池负极的电极反应式为____________________________________.
②若以该电池为电源,用石墨做电极电解200mL含有如下离子的溶液.
| 离子 |
Cu2+ |
H+ |
Cl﹣ |
SO42﹣ |
| c/mol·L﹣1 |
0.5 |
2 |
2 |
0.5 |
电解一段时间后,当两极收集到相同体积(相同条件)的气体时(忽略溶液体积的变化及电极产物可能存在的溶解现象)阳极上收集到氧气的质量为____________.
(1)在9.5g某二价金属的氯化物中含0.2mol Cl—,此氯化物的摩尔质量为;该金属元素的相对原子质量为。
(2) 已知N2、CO2的混合气体的质量共10.0克,标准状况下,体积为6.72L,原混合气体中N2、CO2的体积之比 .
.
(1)写出下列化学反应的离子方程式
①氢氧化钡溶液和硫酸铜溶液的反应
②碳酸钠和足量稀硫酸的反应
(2)根据下列离子方程式,各写一个符合条件的化学方程式
①Fe+2H+====Fe2++H2↑
②HCO3-+ H+====CO2↑+ H2O[来
(1)在氧化还原反应中,反应物中某元素化合价升高,则该反应物发生_______反应(填“氧化”或“还原”,下同),做_______剂;从电子转移角度分析,________剂得到电子,发生________反应。
(2)火药是中国的“四大发明”之一,永远值得炎黄子孙骄傲,也永远会激励着我们去奋发图强。黑火药在发生爆炸时,发生如下的反应:
2KNO3+C+S===K2S+2NO2↑+CO2↑。其中被还原的元素是(填元素符号),
还原剂是(填化学式,下同),氧化产物是。
有下列物质:①Fe ②CO2 ③H2SO4④Ba(OH)2溶液 ⑤氨水 ⑥NaHSO4
其中属于酸的是 (填序号,下同),属于盐的是 ,属于氧化物的是,属于电解质的是 ,可导电的是。
(9分)下表是不同温度下水的离子积常数:
| 温度/℃ |
25 |
t1 |
t2 |
| 水的离子积常数 |
1×10-14 |
a |
1×10-12 |
试回答以下问题:
(1)若25<t1<t2,则a________1×10-14(填“>”、“<”或“=”), 做此判断的理由是____________________________________
做此判断的理由是____________________________________ ____________________________________
____________________________________
(2)25℃时,某Na2SO4溶液中c(SO)=5×10-4 mol/L,取该溶液1 mL加水稀释至10 mL,则稀释后溶液中c(Na+)∶c(OH-)=________。
(3)t2℃时,将pH=11的苛性钠溶液V1 L与pH=1的稀硫酸V2 L混合(设混合后溶液的体积为原两溶液体积之和),所得混合溶液的pH=2,则V1∶V2=________。此溶液中各种离子的浓度由大到小的顺序是________。