咖啡酸(下式中的A)是某种抗氧化剂成分之一,A与FeCl3溶液反应显紫色。
(1)咖啡酸中含氧官能团的名称为__________。
(2)咖啡酸可以发生的反应是__________ (填写序号)。
①氧化反应 ②加 成反应 ③酯化反应 ④加聚反应 ⑤消去反应
成反应 ③酯化反应 ④加聚反应 ⑤消去反应
(3)咖啡酸可看作l,3,4-三取代苯,其中两个相同的官能团位于邻位,取代基中不含支链。则咖啡酸的结构简式为____________________。
(4)3.6 g咖啡酸与足量碳酸氢钠反应生成气体(标准状况) __________mL。
(5)蜂胶的主要活性成分为CPAE,分子式为C17H16O4,该物质在一定条件下可水解生成咖啡酸和一种醇,该醇为芳香醇,且分子结构中无甲基,则咖啡酸跟该芳香醇在一定条件 下反应生成CPAE的化学方程式为____________________。
下表给出了五种元素的相关信息,其中A、B、C、D为短周期元素。
| 元素 |
相 关 信 息 |
| A |
在常温、常压下,其单质是气体,随着人类对环境的认识和要求的提高,它将成为倍受青睐的清洁燃料。 |
| B |
工业上通过分离液态空气获得其单质,其某种同素异形体是保护地球地表环境的重要屏障。 |
| C |
植物生长三要素之一,它能形成多种氧化物,其中一种是早期医疗中使用的麻醉剂。 |
| D |
室温下其单质呈粉末状固体,加热易熔化。该单质在氧气中燃烧,发出明亮的蓝紫色火焰。 |
| E |
它是人体不可缺少的微量元素,其单质也是工业生产中不可缺少的金属原材料,常用于制造桥梁、轨道等。 |
根据上述信息填空:
(1)E 在元素周期表中的位置是
(2)D的单质与烧碱水溶液加热时自身的氧化还原反应生成两种具有强还原性的阴离子,写出该反应的离子方程式。
(3)C与A形成的化合物X,分子中原子个数比为1∶2;相同条件时,相同质量时,氢气的体积为X气体体积的16倍;分子中有极性键和非极性键,可作火箭燃料。写出X分子的电子式
(4)以上这五种元素能组成一种工业上用途极广的复盐(类似明矾,含一种阴离子和两种阳离子),该物质中的A、B、C、D、E的质量比为5∶56∶7∶16∶14。请写出该化合物的化学式(要求:用离子及分子最简单个数比的形式表达)
现有如下两个反应:
A.2NaOH+H2SO4 = Na2SO4+2H2O B.CH4+2O2 = CO2+2H2O
(1)根据反应的本质,两个反应都为反应(放热或吸热),判断两个反应能否设计为原电池?(填“能或不能”)AB
(2)如果能,最好应选择作电解质溶液(NaOH或H2SO4)。则负极电极反应式:,正极电极反应式:(若均不能则此问不填)
Zn-MnO2干电池应用广泛,其电解质溶液是ZnCl2-NH4Cl混合溶液。
(1)该电池的负极材料是 。负极的电极反应为
(2)若ZnCl2-NH4Cl混合溶液中含有杂质Cu2+,会加速某电极的腐蚀,其主要原因是 。欲除去Cu2+,最好选用下列试剂中的 (填代号)。
a.NaOH b.Zn c.Fe d.NH3·H2O
有一包固体物质,可能含有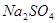 、
、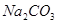 、
、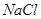 、
、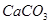 、
、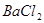 、
、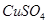 中的一种或几种,现做如下实验。请填空回答其中的问题:
中的一种或几种,现做如下实验。请填空回答其中的问题:
(1)将此固体充分溶解于水中,得到白色沉淀,上层为无色溶液;过滤后,在白色沉淀中滴加足量稀硝酸,未见沉淀溶解。由此可知,原固体物质中一定含有,可能含有。
(2)为确定原固体物质中“可能含有”的物质是否存在,现取3.5g原固体,充分溶于水中,将得到的白色沉淀洗涤、烘干后称量,质量为2.33g。通过计算确定:“可能含有”的物质(选填“一定存在”、“一定不存在”或“仍不能确定是否存在”)。
2010年春,发生在滇、黔、桂、渝、川等省的严重旱情牵动了全国人民的心。水是组成生命体的重要化学物质,有关水的反应有很多。
(1)用电子式表示H2O的形成过程。
(2) H2O以键结合(填极性键、非极性键、离子键)
(3)在pH=1的溶液中,①NH4+、Al3+、Br-、SO42-② Na+、Fe2+、Cl-、NO3-
③K+、Ba2+、Cl-、NO3-④K+、Na+、HCO3-、SO42-四组离子中,一定大量共存的是(填序号)。
(4)在下列反应中,水仅做氧化剂的是(填字母,下同),水既不做氧化剂又不做还原剂的是。
| A.Cl2+H2O=HCl+HClO | B.2Na2O2+2H2O=4NaOH+O2↑ |
| C.CaH2+2H2O=Ca(OH)2+2H2↑ | D.3Fe+4H2O Fe3O4+4H2 Fe3O4+4H2 |
(5)已知KH和H2O反应生成H2和KOH,反应中1mol KH(填失去,得到)mol电子
(6)“神舟七号”飞船上的能量主要来自于太阳能和燃料电池,H2、O2和KOH的水溶液可形成氢氧燃料电池,负极的电极反应为,电极反应产生的水经冷凝后可作为航天员的饮用水,当得到1.8 L饮用水时,电池内转移的电子数约为。