按题给要求填空
(1)按官能团的不同,可将有机物分为
| A.烷烃 | B.烯烃 | C.炔烃 | D.醚 E.酚 F.醛 |
G.羧酸 H.苯的同系物 I.酯 J.卤代烃 K.醇等,请指出下列有机物的种类(填写字母)。
①CH3CH2CH2CHO ____; ②  ______; ③
______; ③ _______;
_______;
④ __ __;⑤
__ __;⑤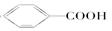 ___ ___; ⑥
___ ___; ⑥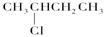 __ ___。
__ ___。
(2)分子式为C6H12的某烃的所有碳原子都在同一平面上,则该烃的结构简式为_________,
若分子式为C4H6的某烃中所有的碳原子都在同一条直线上,则该烃的结构简式为______。
对于混合物的分离或提纯,常采用的方法有:过滤、蒸发、蒸馏、萃取、加热分解等。下列各组混和物的分离或提纯应采用什么方法?
(1)实验室中的石灰水久置,液面上常悬浮有CaCO3微粒。可用的方法除去Ca(OH)2溶液中悬浮的CaCO3微粒。
(2)用CCl4提取溴水中的溴,可采用的方法。
(3)粗盐中含有不溶性的泥沙、可溶性的氯化钙、氯化镁及一些硫酸盐。对粗盐中的这些杂质可采用和的方法除去。
(4)除去氧化钙中的碳酸钙可用的方法。
现有①铁片 ②NaCl溶液③氨水④醋酸⑤酒精⑥盐酸 ⑦H2SO4
⑧KOH固体 ⑨蔗糖 ⑩KAl(SO4)2·12H2O,其中能导电的是,属于电解质的是_______,属于非电解质的是,属于酸的是,属于碱的是。(填序号)
美国化学家R.F.Heck因发现如下Heck反应而获得2010年诺贝尔化学奖。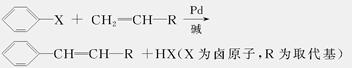

回答下列问题:
(1)C与浓H2SO4共热生成F,F能使酸性KMnO4溶液褪色,F的结构简式______。D在一定条件下反应生
成高分子化合物G,G的结构简式是___________________________。
(2)在A→B的反应中,检验A是否反应完全的试剂是_______________________________。
(3)E的一种同分异构体K符合下列条件:苯环上有两个取代基且苯环上只有两种不同化学环境的氢,与FeCl3溶液作用显紫色。K与过量NaOH溶液共热,发生反应的方程式为_________________________________________________________________________。
有机物A、B、C、D、E、F的转化关系如下: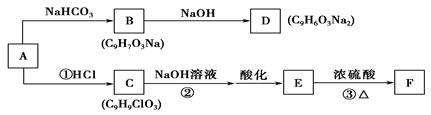
已知:①A是芳香族化合物,其苯环上有2个对位取代基,均不含支链,遇FeCl3溶液能发生显色反应。
②F分子中除了2个苯环外,还含有一个六元环。
请回答下列问题:
(1)A中含有________种官能团,A与足量溴水反应的化学方程式是_______________________。
(2)反应①~③中属于加成反应的有________(填序号)。
(3)C的结构简式为________________,F的结构简式为__________________。
(4)A→B的化学方程式是__________________________________________。
咖啡酸具有止血功效,存在于多种中药中,其结构简式为: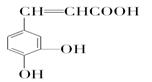
(1)写出咖啡酸中两种含氧官能团的名称:__________________ 、________________。
(2)1mol咖啡酸分别与足量H2、浓溴水和氢氧化钠溶液反应,消耗三种试剂的物质的量依次为:H2__________mol;Br2______________mol;NaOH_____________mol。
(3)蜂胶的分子式为C17H16O4,在一定条件下可水解生成咖啡酸和一种醇A,则醇A的分子式为______________________________。
(4)已知醇A含有苯环,且分子结构中无甲基,写出醇A在一定条件下与乙酸反应的化学方程式:________________________________________________________________。