工业上常用铁质容器盛装冷的 浓酸。为研究铁质材料与热的浓硫酸的反应,某学习小组进行了以下探究活动:
浓酸。为研究铁质材料与热的浓硫酸的反应,某学习小组进行了以下探究活动:
(1)将已去除表面氧化物的铁钉(碳素钢)放入冷得浓硫酸中,10分钟后移入硫酸铜溶液中,片刻后取出观察,铁钉表面无明显变化,其原因是 。
(2)称取铁钉6.0g放入15.0mL浓硫酸中,加热,充分反应后得到溶液X并收集到气体Y 。甲同学认为X中除Fe3+外还可能
。甲同学认为X中除Fe3+外还可能 含有Fe2+。若要确认其中存在Fe2+,需要进行的实验操作、现象和结论是 _。
含有Fe2+。若要确认其中存在Fe2+,需要进行的实验操作、现象和结论是 _。
乙同学认为气体Y中除含有SO2、H2外,还可能含有CO 2气体。为此设计了下列探究实验装置(图中夹持仪器省略)。
2气体。为此设计了下列探究实验装置(图中夹持仪器省略)。
①认为气体Y中还含有CO2的理由是 (用化学方程式表示)。
②装置A中试剂的作用是 。
③为确认CO2的存在,需在装置中添加M于 (选填序号)。
a.A之前 b.A-B间 c.B-C间 d.C-D间
④能说明气体Y中含有H2的实验现象是 。
[广东卷] 某小组用如图装置及药品(部分略去)探究工业制硫酸的过程。
(1)检查完装置的气密性,加入药品开始实验,此时首先应进行的操作是
(2)实验时A中氧气导管冒出的气泡与SO2导管冒出的数量相近,目的是: ,SO3在装置 中被吸收,装置D中盛放的溶液是: 。
(3)实验结束后,为使装置中残留的SO2、SO3被充分吸收,操作方法是
(4)有人设想用如图所示装置,根据电化学原理将SO2转化为重要的化工原料。A为SO2,B为O2,则负极是 (填左、右),负极的电极反应为 ;一段时间后,溶液的pH变 。
(15分)已知:BaSO4(s)+4C(s) 高温4CO(g)+BaS(s)
工业上以重晶石矿(主要成分BaSO4,含杂质Fe2O3、SiO2)为原料,通过下列流程生产氯化钡晶体(BaCl2·nH2O)。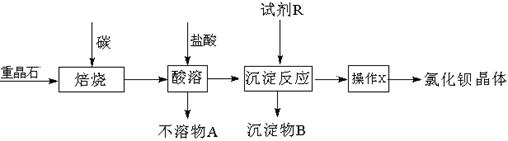
(1)若按以上流程在实验室焙烧重晶石矿,回收处理所产生的气体,恰当的方法是(填字母编号)。
a.用澄清石灰水吸收气体 b.用浓硫酸吸收气体 c.点燃气体
(2)焙烧重晶石矿时,可能发生的副反应的化学方程式是 (写两个)。
(3)为测定产品氯化钡晶体(BaCl2·nH2O)中的n值,设计下列实验步骤,请补充完善空缺项的实验步骤:①称量样品;②灼烧样品;③置于(填仪器名称)中冷却;④;⑤恒重操作。恒重操作的目的是;若最终测出的n值偏大,可能的实验操作误差原因是(举例一种情况)。
(4)用下列装置组合也可完成(3)中实验。请选择下列恰当的装置组合(称量、加热和夹持仪器省略),完成上述实验:(用装置代号以“A
 ……
…… ”形式表示,每套装置不可重复使用)
”形式表示,每套装置不可重复使用)
(5)将重晶石矿与碳、氯化钙共同焙烧,可以直接得到氯化钡,反应的化学方程式为:
BaSO4+4C+CaCl2高温4CO +CaS+BaCl2。以下是从焙烧后的固体中分离得到氯化钡晶体的实验流程设计(已知硫化钙不溶于水,易溶于盐酸)。请在空格方框横线上填写操作名称。
+CaS+BaCl2。以下是从焙烧后的固体中分离得到氯化钡晶体的实验流程设计(已知硫化钙不溶于水,易溶于盐酸)。请在空格方框横线上填写操作名称。
铵盐在工农业生产中有着重要的用途,请根据要求完成下列各题。
Ⅰ.某化学兴趣小组欲从下列装置中选取必要的装置制取(NH4)2SO4溶液。
(1)仪器连接的顺序(用接口序号字母表示)是:a
(2)试从电离平衡角度分析该实验装置A中能产生氨气的原因:
。
(3)将装置C中两种液体分离开的操作名称是。
(4)(NH4)2SO4“低毒,有刺激性,有吸湿性、吸湿后固结成块”。储存应注意。
Ⅱ.为提高氯化铵的经济价值,我国化学家设计了利用氢氧化镁热分解氯化铵制氨气并得到碱式氯化镁[Mg(OH)Cl]的工艺。某同学根据该原理设计的实验装置如图:
请回答下列问题:
(1)装置A中发生反应生成碱式氯化镁的化学方程式为。
(2)反应过程中持续通入N2的作用有两点:一是使反应产生的氨气完全导出并被稀硫酸充分吸收,
二是。
(3)由MgCl2溶液蒸发得到MgCl2·6H2O晶体,蒸发的目的是_________。
a.得到热饱和溶液b.析出晶体
(4)镁是一种用途很广的金属材料,目前世界上60%的镁从海水中提取。
①若要验证所得无水MgCl2中不含NaCl,最简单的操作方法是:
。
②由MgCl2·6H2O制备无水MgCl2的操作在氛围中进行,若在空气中加热,则会生成Mg(OH)Cl。
化学实验是科学探究的基础。请回答有关实验问题:
(1)下面的四个实验装置有三个都存在明显缺陷,其中完全正确的是:
(2)要检验上面B装置氨气已集满的操作是则试管已集满。
(3)ClO2是一种安全、高效、广谱、强力杀菌剂,其性质如右表:
| 色态 |
溶于碱 |
超过1Kpa、受热或遇光 |
|
| 常温气体 |
-59-11℃红黄色液体 |
生成亚氯酸盐和氯酸盐 |
爆炸 |
①由右表可以看出:保存液态ClO2的条件是密封、;ClO2与碱反应的离子方程式为;观察右下“图A”,要从NaClO2溶液制得不含结晶水的晶体,操作是蒸发结晶,控制条件是;应控制析出晶体的温度范围是。
②工业用潮湿的KClO3和草酸(H2C2O4)在60℃时反应制得。某学生拟用下图B所示装置模拟工业制法制取并收集液态ClO2,请模仿下图B的装置图和图例,在答题卡的相应图中补充完善装置图,并作必要的标注。
(17分)黄铜矿是工业炼铜的主要原料,其主要成分为CuFeS2,现有一种天然黄铜矿(含少量脉石SiO2),为了测定该黄铜矿的纯度,某同学设计了如下实验:
称取研细的黄铜矿样品1.150g,在空气存在的条件下进行煅烧。实验后取d中溶液的1/10置于锥形瓶中,用0.05mo1/L标准碘溶液进行滴定,初读数为0.10mL,终读数如右上图所示。
(1)黄铜矿煅烧的反应为8CuFeS2+21O2高温8Cu+4FeO+2Fe2O3+16SO2,该反应中被还原的元素是___(填元素符号)。
(2)标准碘溶液应盛放在(填“碱式”或“酸式”)________滴定管中;装液之前,滴定管要用标准碘溶液润洗2—3次,润洗的操作是:。请用化学方程式表示滴定的原理:。
(3)滴定终点的读数为mL;通过计算可知,该黄铜矿的纯度为。
(4)若去掉c装置,会使测定结果(填“偏低”“偏高”或“无影响”)。
(5)假设实验操作均正确,测得黄铜矿的纯度偏低,可能的原因主要有。