铵盐在工农业生产中有着重要的用途,请根据要求完成下列各题。
Ⅰ.某化学兴趣小组欲从下列装置中选取必要的装置制取(NH4)2SO4溶液。
(1)仪器连接的顺序(用接口序号字母表示)是:a
(2)试从电离平衡角度分析该实验装置A中能产生氨气的原因:
。
(3)将装置C中两种液体分离开的操作名称是 。
(4)(NH4)2SO4“低毒,有刺激性,有吸湿性、吸湿后固结成块”。储存应注意 。
Ⅱ.为提高氯化铵的经济价值,我国化学家设计了利用氢氧化镁热分解氯化铵制氨气并得到碱式氯化镁[Mg(OH)Cl]的工艺。某同学根据该原理设计的实验装置如图:
请回答下列问题:
(1)装置A中发生反应生成碱式氯化镁的化学方程式为 。
(2)反应过程中持续通入N2的作用有两点:一是使反应产生的氨气完全导出并被稀硫酸充分吸收,
二是 。
(3)由MgCl2溶液蒸发得到MgCl2·6H2O晶体,蒸发的目的是_________。
a.得到热饱和溶液 b.析出晶体
(4)镁是一种用途很广的金属材料,目前世界上60%的镁从海水中提取。
①若要验证所得无水MgCl2中不含NaCl,最简单的操作方法是:
。
②由MgCl2·6H2O制备无水MgCl2的操作在 氛围中进行,若在空气中加热,则会生成Mg(OH)Cl。
(8分)(1) 某实验室要用90mL1.00 mol·L-1的NaOH溶液。在配制该NaOH溶液的过程中:
①除了要使用托盘天平、药匙、烧杯、玻璃棒、胶头滴管,还要使用的仪器有。
②需用托盘天平称取NaOH的质量为g。
(2)从海带中提取碘的流程如下图: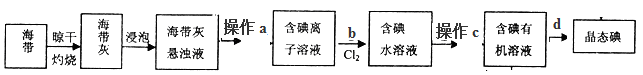
①指出提取碘的过程中实验操作、操作的名称:a__________、c__________
②在3mL碘水中,加入1mL四氯化碳,振荡、静置后,观察到试管里的分层现象是
。(注:下图试管中深色区为紫红色溶液)
(6分)A、B、C、D四种可溶性化合物,分别由阳离子Fe3+、Ba2+、Al3+、Na+和阴离子OH-、SO42-、Cl-、CO32-中的各一种组成(离子不重复)。通过实验,得出如下结论:
①A和D的溶液显碱性,0.1mol·L-1A溶液的pH小于13;
②铜粉能溶解在B的溶液中;
③往C的溶液中加入过量的D溶液,最终没有沉淀。
根据以上实验事实,回答下列问题:
(1) 试写出A和B的化学式:A,B___________。
(2) 试写出实验③中反应的离子方程式。
如图所示是在实验室进行氨气快速制备与性质实验的组合装置,部分固定装置未画出。
(l)写出装置A中所发生的化学反应
(2)装置B中盛放试剂是
(3)点燃C处酒精灯,关闭弹簧夹2,打开弹簧夹1,从分液漏斗放出浓氨水至浸没烧瓶中固体后关闭分液漏斗,稍后片刻,装置C中黑色固体逐渐变红,装置E中溶液里出现大量气泡,同时产
生(填写反应现象);从E中逸出液面的气体可以直接排入空气,请写出在C中发生反应的化学方程式
(4)已知Cu2O是一种红色固体物质, 在高温条件下可由CuO分解得到:4CuO=2Cu2O+O2↑,生成的Cu2O 也能被NH3还原。当C中固体全部变红色后,关闭弹簧夹1,慢慢移开酒精灯,待冷却后,称量C中固体质量。若反应前固体质量为16g,反应后称重固体质量减少2.4g。通过计算确定该固体产物的成分是(用化学式表示)
(5)在关闭弹簧夹1后,打开弹簧夹2,残余气体进入F中,很快发现装置F中产生白烟,同时发现G中溶液迅速倒吸流入F中。写出产生白烟的化学方程式
(12分)某研究小组欲探究SO2的化学性质,设计了如下实验方案。
(1)在B中检验SO2的氧化性,则B中所盛试剂可为________。
(2)在C中装FeCl3溶液,检验SO2的还原性,则C中反应的离子方程式为__________________________。
(3)在D中装新制漂白粉浓溶液。通入SO2一段时间后,D中出现了大量白色沉淀。同学们对白色沉淀成分进行了探究。请回答下列问题:
限选的仪器和试剂:过滤装置、试管、滴管、带导管的单孔塞、蒸馏水、0.5 mol·L-1盐酸、0.5 mol·L-1H2SO4溶液、0.5 mol·L-1BaCl2溶液、品红溶液、新制澄清石灰水。
(ⅰ)假设一:该白色沉淀为CaSO3;
假设二:该白色沉淀为________;
假设三:该白色沉淀为上述两种物质的混合物。
(ⅱ)基于假设一,填写下表:
| 实验操作 |
预期现象和结论 |
| 将D中沉淀过滤,洗涤干净备用 |
|
| 用另一干净试管取少量沉淀样品,加入 ______ |
__________ |
(ⅲ)若假设二成立,试写出生成该白色沉淀的化学方程式:
__________________________________________________。
下图为制取乙酸乙酯的实验装置图。回答下列问题: 
揭示实验原理
乙酸与乙醇在催化剂存在的条件下加热可以发生反应生成乙酸乙酯。请用氧同位素示踪法写出乙酸与乙醇发生酯化反应的化学方程式______________________。
能否用氢同位素示踪法揭示酯化反应原理? _______(选填“能”或“不能”),原因是___________________。
反应温度确定:
合成乙酸乙酯的反应为放热反应。实验表明,反应温度应控制在85℃左右为宜。回答:
实验温度不宜低于85℃左右的原因是__________________________________________;
实验温度不宜高于85℃左右的原因是__________________________________________;
实验装置的比较:
利用右图装置制备乙酸乙酯,这种装置与教材装置相比较突出的优点是___________。
酯层厚度的标示:
为更好地测定酯层厚度,可预先向饱和Na2CO3溶液中滴加1滴____试液,现象是___________。