I. 下列实验操作或对实验事实的描述不正确的是 (填序号)
①分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出
②向沸腾的NaOH稀溶液中滴加FeCl3饱和溶液,以制备Fe(OH)3胶体
③石油的分馏实验中,需将温度计的水银球插入液面以下以控制液体温度
④用瓷坩埚熔化各种钠的化合物
⑤测溶液大致的pH:用玻璃棒蘸取溶液滴在湿润的pH试纸上,与标准比色卡对照
⑥向NaOH溶液中滴加Al2(SO4)3溶液和向Al2(SO4)3溶液中滴加NaOH溶液现象不同
⑦可用饱和碳酸氢钠溶液除去二氧化碳中混有的少量二氧化硫
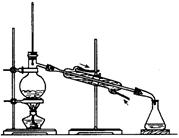
II. (6分)某同学设计了如图所示的套管实验装置(部分装置未画出)来制备SO2并利用实验现象来检验其还原性,制备SO2时选用的试剂为Cu和浓H2SO4。回答下列问题: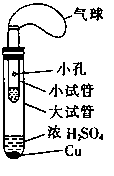
(1)写出制取SO2的化学方程式: 。
(2)该反应中浓H2SO4表现的化学性质有 。
(3)该同学利用实验现象来检验SO2的还原性,则选用的试剂为 。
A.双氧水(H2O2) B.品红溶液 C.酸性高锰酸钾溶液
检验SO2还原性的试管中的现象为 。
(6分)配制500 mL 1.0 mol/L的NaCl溶液时,下列操作会使实际浓度偏高,偏低还是不变,请填空:
(1).摇匀后,液面低于刻度线,没有再加水;
(2).移液过程中,不小心溅出少量溶液;
(3).定容时,俯视刻度线;
(每空2分,共10分)(用标准氢氧化钠溶液滴定未知浓度的盐酸时,现有下列仪器或用品:①铁架台(含铁圈、各种铁夹);②锥形瓶;③滴定管(酸式与碱式);④烧杯(若干个);⑤玻璃棒;⑥天平(含砝码);⑦滤纸;⑧量筒;⑨漏斗。
有下列药品:①NaOH固体;②标准NaOH溶液;③未知浓度的盐酸;试回答以下问题。
(1)做酸碱中和滴定时,还缺少的试剂是。
(2)指出滴定过程中的如下操作,对滴定结果的影响(填“偏高”、“偏低”或“无影响”)
①滴定前未用标准NaOH溶液润洗滴定管;
②滴定前用待测盐酸润洗锥形瓶;
③滴定结束时俯视碱式滴定管刻度。
④碱式滴定管滴定前有气泡,滴定终点时气泡消失。
实验室需要0.1 mol/L NaOH溶液450 mL和0.5 mol/L硫酸溶液450 mL.根据这两种溶液的配制情况回答下列问题: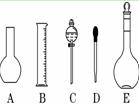
(1)如图 所示的仪器中配制溶液肯定不需要的是 (填序号),
所示的仪器中配制溶液肯定不需要的是 (填序号),
仪器C的名称是,
本实验所需玻璃仪器E规格为 mL。
(2)下列操作中,容量瓶所不具备的功能有 (填序号)。
A.配制一定体积准确浓度 的标准溶液 的标准溶液 |
B.长期贮存溶液 |
| C.用来加热溶解固体溶质 | D.量取一定体积的液体 |
(3)在配制NaOH溶液实验中,其他操作均正确。若定容时仰视刻度线,则所配制溶液浓度0.1 mol/L(填“大于”“等于”或“小于”,下同)。若NaOH溶液未冷却即转移至容量瓶定容,则所配制溶液浓度 0.1 mol/L。
(4)根据计算得知,所需质量分数为98%、密度为1.84 g/cm3的浓硫酸的体积为 mL(计算结果保 留一位小数)。如果实验室有10 mL、25mL、50 mL量筒,应选用 mL规格的量筒最好。
留一位小数)。如果实验室有10 mL、25mL、50 mL量筒,应选用 mL规格的量筒最好。
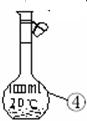
(1)写出下图中序号①~④仪器的名称: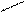
|

某学生欲用已知物质的量浓度的盐酸来测定未知物质的量浓度的氢氧化钠溶液时,选择酚酞作指示剂。请填写下列空白:
(1)用标准的盐酸溶液滴定待测的氢氧化钠溶液时,左手把握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视______________________。直到____________________________为止。
(2)下列操作中可能使所测氢氧化钠溶液的浓度数值偏低的是_______________。
| A.酸式滴定管未用标准盐酸溶液润洗就直接注入标准盐酸溶液 |
| B.滴定前盛放氢氧化钠溶液的锥形瓶用蒸馏水洗净后没有干燥 |
| C.酸式滴定管在滴定前有气泡,滴定后气泡消失 |
| D.读取盐酸体积时,开始仰视读数,滴定结束时俯视读数 |
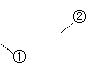
(3)若滴定开始和结束时,酸式滴定管中的液面如图所示,请将数
据填入下面表格的空白处。
| 滴定次数 |
待测氢氧化钠溶液的体积/ mL |
0.1000 mol/L 盐酸的体积/ mL |
||
| 滴定前刻度 |
滴定后刻度 |
溶液体积/ mL |
||
| 第一次 |
25.00 |
|||
| 第二次 |
25.00 |
1.56 |
28.08 |
26.52 |
| 第三次 |
25.00 |
0.22 |
26.34 |
26.12 |
(4)请根据上表中数据列式计算该氢氧化钠溶液的物质的量浓度:c(NaOH)=__。