某学生欲用已知物质的量浓度的盐酸来测定未知物质的量浓度的氢氧化钠溶液时,选择酚酞作指示剂。请填写下列空白:
(1)用标准的盐酸溶液滴定待测的氢氧化钠溶液时,左手把握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视______________________。直到____________________________为止。
(2)下列操作中可能使所测氢氧化钠溶液的浓度数值偏低的是_______________。
| A.酸式滴定管未用标准盐酸溶液润洗就直接注入标准盐酸溶液 |
| B.滴定前盛放氢氧化钠溶液的锥形瓶用蒸馏水洗净后没有干燥 |
| C.酸式滴定管在滴定前有气泡,滴定后气泡消失 |
| D.读取盐酸体积时,开始仰视读数,滴定结束时俯视读数 |
(3)若滴定开始和结束时,酸式滴定管中的液面如图所示,请将数 
据填入下面表格的空白处。
| 滴定次数 |
待测氢氧化钠溶液的体积/ mL |
0.1000 mol/L 盐酸的体积/ mL |
||
| 滴定前刻度 |
滴定后刻度 |
溶液体积/ mL |
||
| 第一次 |
25.00 |
|
|
|
| 第二次 |
25.00 |
1.56 |
28.08 |
26.52 |
| 第三次 |
25.00 |
0.22 |
26.34 |
26.12 |
(4)请根据上表中数据列式计算该氢氧化钠溶液的物质的量浓度:c(NaOH)= __。
孔雀石主要成分是Cu2(OH)2CO3,还含少量难溶的FeCO3及Si的化合物,实验室以孔雀石为原料制备硫酸铜晶体的步骤如下: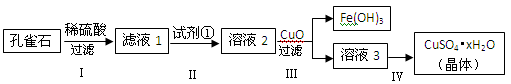
(1)步骤Ⅰ中涉及的反应用离子方程式表示为_____________________________。
(2)为将溶液中Fe2+氧化成Fe3+步骤Ⅱ中加入的试剂①最好是__________(填代号)。
a.KMnO4 b.H2O2 c.Fe粉 d.KSCN
(3)步骤Ⅳ获得硫酸铜晶体,需要经过_________、_________、过滤等操作。
(4)孔雀石与焦炭一起加热可以生成Cu及其它无毒物质,写出该反应的化学方程式_____________。
(5)测定硫酸铜晶体(CuSO4·xH2O)中结晶水的x值:称取2.5g硫酸铜晶体,加热至质量不再改变时,称量粉末的质量为1.6g。则计算得x=______
某同学为了验证碳和硅两种元素非金属性的相对强弱,用下图所示装置进行实验(夹持仪器已略去,气密性已检验)。
实验操作步骤:
Ⅰ.打开弹簧夹1,关闭弹簧夹2,并打开活塞a,滴加盐酸。
Ⅱ.A中看到白色沉淀时,…,关闭活塞a。
请回答:
(1)B中反应的离子方程式是________。
(2)通过步骤Ⅰ得知盐酸具有的性质是________(填字母)。
| A.挥发性 | B.还原性 | C.氧化性 | D.酸性 |
(3)C装置的作用是________,X是________(写化学式)。
(4)为了验证碳的非金属性强于硅,步骤Ⅱ中未写的操作和现象是________,D中反应的化学方程式是________。
(5)碳、硅的非金属性逐渐减弱的原因是________(从原子结构角度加以解释)。
实验室制取少量溴乙烷的装置如下图所示。根据题意完成下列填空: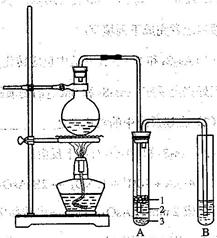
(1)圆底烧瓶中加入的反应物是溴化钠、和1:1的硫酸。配制体积比1:1的硫酸所用的定量仪器为(选填编号)。
a.天平 b.量筒 c.容量瓶 d.滴定管
(2)写出加热时烧瓶中发生的主要反应的化学方程式。
(3)将生成物导入盛有冰水混合物的试管A中,冰水混合物的作用是。
试管A中的物质分为三层(如图所示),产物在第层。
(4)试管A中除了产物和水之外,还可能存在、(写出化学式)。
(5)用浓的硫酸进行实验,若试管A中获得的有机物呈棕黄色,除去其中杂质的正确方法是(选填编号)。
a.蒸馏 b.氢氧化钠溶液洗涤
c.用四氯化碳萃取 d.用亚硫酸钠溶液洗涤
若试管B中的酸性高锰酸钾溶液褪色,使之褪色的物质的名称是。
(6)实验员老师建议把上述装置中的仪器连接部分都改成标准玻璃接口,其原因是:。
试回答下列中和热测定的有关问题
(1)实验桌上备有烧杯(大、小两个烧杯)、泡沫塑料、泡沫塑料板、环形玻璃搅拌棒、0.50mol·L-1盐酸、0.55mol·L-1NaOH溶液,尚缺少的实验用品是________________。
(2)实验中能否用环形铜丝搅拌棒代替环形玻璃搅拌棒(填“能”或“不能”)__________,其原因是______________________________________________。
(3)实验时所用盐酸及NaOH溶液的体积均为50mL,各溶液密度为1g/cm3,生成溶液的比热容c=4.18J/(g·℃),实验起始温度为20℃,终止温度为23.2℃。试计算该反应的中和热ΔH=_________。
(12分)某化学兴趣小组用下图所示装置进行探究实验,以验证产物 中有乙烯生成且乙烯具有不饱和性。当温度迅速上升后,可观察到试管中溴水褪色,烧瓶中浓H2SO4与乙醇的混合液体变为棕黑色。
(1)写出该实验中生成乙烯使溴水褪色的化学方程式:_______________________。
(2)甲同学认为:考虑到该混合液反应的复杂性,溴水褪色的现象不能证明反应中有乙烯生成且乙烯具有不饱和性,其理由正确的是()
a.乙烯与溴水易发生取代反应
b.使溴水褪色的反应,未必是加成反应
c.使溴水褪色的物质,未必是乙烯
(3)乙同学经过细致观察后认为试管中液体分层,油状液体在下层的现象可证明反应中有乙烯生成,请你写出下层该物质与NaOH水溶液加热反应的化学方程式 __________________。
(4)丙同学对上述实验装置进行了改进,在Ⅰ和Ⅱ之间增加如图装置,以除去乙烯中的杂质气体,则A中的试剂应为B中的试剂应为________,气体经过B无现象即可证明是较为纯净的乙烯。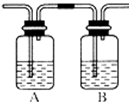
(5)若证明乙烯和溴发生的是加成反应,而不是取代反应,可将产生的气体经净化后通入溴的四氯化碳溶液,再接入如图装置,向 D中加入_________溶液,若无淡黄色沉淀产生,则能证明。