某同学设计实验证明铜与浓硫酸能发生反应,并检验生成气体的性质,如图所示,在试管里加入2mL浓硫酸,用带导管和一个小孔的胶管塞紧,从孔中插入一根铜丝,加热,把放出的气体依次通入品红溶液和石蕊溶液中。
请回答下列问题:
(1)写出铜与浓硫酸反应的化学方程式: 。
(2)试管a、b分别检验生成气体的性质,写出观察到的现象及其作用。
试管a中的现象是 ,作用是 。
试管b中的现象是 ,作用是 。
(共14分)用18mol/L的浓硫酸配制3mol/L的稀硫酸100mL,按正确的操作顺序,将序号
填入括号内并填写下列空格。
( )用少许蒸馏水洗涤小烧杯,将洗涤液沿_______注入__________并重复2次。
( )将浓硫酸沿烧杯壁慢慢注入盛有少量蒸馏水的小烧杯中,并用玻璃棒不断搅拌。
( )用量筒取浓硫酸______mL。
( )将容量瓶盖紧摇匀。
( )将已冷却的硫酸溶液沿________注入________中。
( )改用胶头滴管加蒸馏水,使溶液凹液面最低处恰好与刻度线相切。
( )继续向容量瓶内小心加蒸馏水,直至接近刻度线__________cm处。
若实验遇到下列情况,对所配溶液中硫酸的物质的量浓度有何影响(填偏高、
偏低、无影响)。
(1)用量筒量取浓硫酸时俯视刻度线___________;
(2)稀释过程中不慎有硫酸液滴溅出____________;
(3)未将洗涤液加入容量瓶___________;
(4)定容时仰视刻度线__________;
(5)摇匀后发现凹液面下降,又加蒸馏水至刻度线__________;
(6)配制前容量瓶用水洗涤后未进行干燥处理__________。
文献资料显示某地区的酸雨主要为硫酸型和盐酸型酸雨。某兴趣小组对酸雨进行实验研究。
(1)提出合理的假设:该酸雨中的溶质除H2SO4、HC1外,该小组同学根据硫酸型酸雨的形成过程,预测主要溶质还一定有。
(2)设计实验方案验证以上假设。在答题卡上写出实验步骤、预期现象和结论。
限选试剂及义器:盐酸、硝酸、BaC12溶液、Ba(OH)2溶液、AgNO3溶液、紫色石蕊试液、品红溶液、烧杯、试管、胶头滴管。
(3)酸雨部分组成测定:
①滴定:准确量取25.00mL该酸雨于锥形瓶中,加入几滴淀粉溶液,将0.02000mol·L—1 碘水装入50mL酸式滴定管,滴定终点现象为,记录数据,重复滴定2次,平均消耗碘水VmL。
②计算:被碘水氧化的物质的物质的量浓度之和为(只列出算式,不做运算)
用硝酸氧化淀粉水解的产物(C6H12O6)可制得少量草酸,装置如图A所示(加热、搅拌和仪器固定装置均已略去):已知硝酸氧化淀粉水解液过程中可发生下列反应: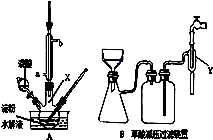
C6H12O6+12HNO3→3H2C2O4+9NO2↑+3NO↑+9H2O
C6H12O6+8HNO3→6CO2+8NO↑+10H2O
3H2C2O4+2HNO3→6CO2+2NO↑+4H2O
实验过程如下:
将1∶1的淀粉水乳液与少许硫酸(98%)加入烧杯中,
水浴加热至85℃~90℃,保持30 min,然后逐渐将温度降至60℃左右;
②将一定量的淀粉水解液加入容器X中;
③控制反应液温度在55~60℃条件下,边搅拌边缓慢滴加一定量含有适量催化剂的混酸(65%HNO3与98%H2SO4的质量比为2:1.5)溶液;
④反应3h左右,冷却,减压过滤后再重结晶得草酸晶体。
请回答下列问题:
(1)容器X的名称:。
(2)冷凝管水的进口是(填a或b);冷凝管冷凝回流的主要物质是 。
(3)实验中若混酸滴加过快,将导致草酸产量下降,其原因是。
(4)该装置最大的一个缺点是 。
(5)草酸重结晶的减压过滤装置如图B。仪器Y接在水龙头上,其作用是 。
减压过滤的操作有:①将含晶体的溶液倒入漏斗;②将滤纸放入漏斗并用水湿润;③打开水龙头;④关闭水龙头;⑤拆下橡皮管。正确的顺序是 。
(6) 将产品在恒温箱内约90℃以下烘干至恒重,得到二水合草酸。用KMnO4标准溶液滴定,该反应的离子方程式为:
2MnO4-+ 5H2C2O4 + 6H+ = 2Mn2++ 10CO2↑+ 8H2O
称取该样品0.12 g,加适量水完全溶解,然后用0.020 mol·L-1
的酸性KMnO4溶液滴定至终点(杂质不参与反应),此时溶液
颜色由变为。滴定前后滴定管中的液面读数如图所
示,则该草酸晶体样品中二水合草酸的质量分数为。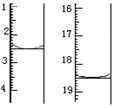
黄铁矿在高温时和氧气反应生成氧化铁和二氧化硫(假设矿石中的杂质不参与化学反应)。某化学学习小组对黄铁矿样品进行如下实验探究:
【实验一】测定硫元素的含量
I.实验装置如下图所示(夹持和加热装置省略)。A中的试剂是双氧水,将m1g该黄铁矿样品放入硬质玻璃管D中。从A向B中逐滴滴加液体,使气体发生装置不断地缓缓产生气体,高温灼烧硬质玻璃管中的黄铁矿样品至反应完全。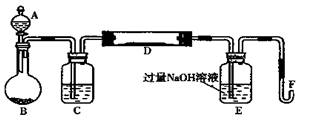
II.反应结束后,将E瓶中的溶液进行如下处理:
【实验二】测定铁元素的含量
III.测定铁元素含量的实验步骤如下:
① 用足量稀硫酸溶解硬质玻璃管D中的固体残渣;
② 加还原剂使溶液中的Fe3+完全转化为Fe2+后,过滤、洗涤;
③ 将滤液稀释至250 ml;
④ 每次取稀释液25.00 ml,用已知物质的量浓度为c mol/L的酸性KMnO4溶液滴定,三次滴定实验所需KMnO4溶液体积的平均值为V ml。
请回答下列问题:
(1)仪器B中发生反应的化学方程式是;仪器C中装入的试剂是。E瓶的作用是。
(2)II中加入H2O2发生反应的离子方程式。
(3)III的步骤③中,需要用到的仪器除烧杯、玻璃棒外,还必须要有;④中取稀释液25.00 ml需用的仪器是。
(4)假设在整个实验过程中硫元素和铁元素没有损失,则该黄铁矿样品中硫元素的质量分数为。(用含m1和m2的代数式表示);该黄铁矿中铁元素的质量分数为。(用含m1、c、V的代数式表示)
为了证明稀硝酸与铜反应的气体产物是NO,某同学设计了如下实验装置和实验方案。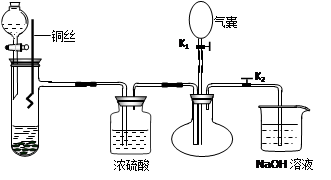
实验步骤:
⑴关闭K1,打开K2,向试管中加石灰石,通过分液漏斗向其中加入一定的稀硝酸,则加入石灰石的作用是______________________________________________________,
反应化学方程式是。
⑵将将铜丝插入稀硝酸中,微热大试管。
该步反应离子方程式是。
⑶充分反应后,打开开关K1,通过气囊鼓入空气,可以观察到烧瓶中,证明稀硝酸与铜反应的气体产物是NO。
⑷NaOH溶液的作用。