I.用下列仪器的编号回答问题:
①容量瓶 ②蒸馏烧瓶 ③量筒 ④烧杯 ⑤托盘天平 ⑥分液漏斗
(1)可加热的仪器且加热时必须垫石棉网的有 ;
(2)使用前必须检查是否漏水的有 ;
(3)仪器上标有零刻度的有 。
II.草木灰中富含钾盐,主要成分是碳酸钾,还含有少量氯化钾和硫酸盐。现从草木灰中提取钾盐,并用实验检验其中的 CO32-、 SO42-、 和 Cl-。
(1)从草木灰中提取钾盐的实验操作顺序如下:①称取样品;②溶解沉降;③ ;④ ;⑤冷却结晶。
(2)在进行上述②、③、④ 操作时,都要用到玻璃棒,其作用分别是:
② ;③ ;④ 。
(3)将制得的少量晶体放入试管,加入蒸馏水溶解并把溶液分成二份,分装在2支试管里。①在第一支试管里加入稀盐酸,可观察有 生成,证明溶液中有 离子。②在第二支试管里加入足量稀硝酸后,再加入足量Ba(NO3)2溶液,可观察到有 生成,证明溶液中有 离子。③将第二支试管反应后的溶液过滤,在滤液里加入AgNO3溶液,可观察到有 生成,证明溶液中有 离子。
(4)用托盘天平称量样品时,若指针偏向右边,则表示 (填选项的标号)。
| A.左盘重,样品轻 | B.左盘轻,砝码重 |
| C.右盘重,砝码轻 | D.右盘轻,样品重 |
为检验浓硫酸与木炭在加热条件下反应产生的SO2和CO2气体,设计了如图所示实验装置,a、b、c为止水夹,B是用于储气的气囊,D中放有用I2和淀粉的蓝色溶液浸湿的脱脂棉。
请回答下列问题:
(1)实验前欲检查装置A的气密性,可以采取的操作是;
(2)此实验成败的关键在于控制反应产生气体的速率不能过快,由此设计了虚框部分的装置,则正确的操作顺序是(用操作编号填写)
①向A装置中加入浓硫酸,加热,使A中产生的气体进入气囊B,当气囊中充入一定量气体时,停止加热;
②待装置A冷却,且气囊B的体积不再变化后,关闭止水夹a,打开止水夹b,慢慢挤压气囊,使气囊B中气体慢慢进入装置C中,待达到实验目的后,关闭止水夹b;
③打开止水夹a和c,关闭止水夹b;
(3)实验时,装置C中的现象为;
(4)当D中产生(多选不得分)现象时,可以说明使E中澄清石灰水变浑浊的是CO2,而不是SO2;
A.进气口一端脱脂棉蓝色变浅,出气口一端脱脂棉蓝色不变
B.脱脂棉上蓝色均变浅
C.脱脂棉上蓝色褪去
装置D的作用为
发生反应用化学方程式可表示为。
实验室制得的氯气通常含有水蒸气和盐酸挥发的氯化氢,要制取干燥纯净的氯气,可用如图所示的装置,进行干燥、净化、收集和尾气处理(C瓶用于收集氯气,D瓶用于尾气处理)。
据此完成下列各题:
(1)实验室通常用饱和食盐水吸收杂质HCl,则图(1)中A瓶和B瓶依次分别盛装的试剂是:_____________________________________;
(2)图(2)是氯气的收集装置,将它安置在图(1)中的虚线框内,其导管的连接顺序是:______________________________;
(3)检查最终尾气排放(导管口c处)是否含有氯气,可用湿润的淀粉-KI试纸测试,如有氯气泄漏,可观察到__________________________________,产生此现象的直接原因是__________________________________;此方法检测氯气,试纸必须用水润湿是因为________________________________________。
实验室利用如右图装置进行中和热的测定.请回答下列问题: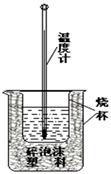
(1)该图中有两处未画出,它们是、.
(2)在操作正确的前提下,提高中和热测定准确性的关键是.
(3)做一次完整的中和热测定实验,温度计需使用_______次.
为了证明在实验室制备Cl2的过程中会有水蒸气和HCl挥发出来,甲同学设计了如下图所示的实验装置,按要求回答问题。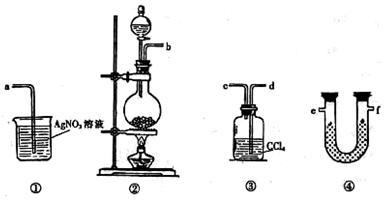

⑴请根据甲同学的意图,连接相应的装置,接口顺序:
b接________,__________接_________,_________接a。
⑵U形管中所盛试剂的化学式为_____________________________。
⑶装置③中CCl4的作用是___________________________________。
⑷乙同学认为甲同学实验中有缺陷,不能证明最终通入AgNO3溶液中的气体只有一种。为了确保实验结论的可靠性,证明最终通入AgNO3溶液中的气体只有一种,乙同学提出在某两个装置之间再加装置⑤。你认为装置⑤应加在_____________之间(填装置序号)。瓶中可以放入______________________________________。
⑸丙同学看到甲同学设计的装置后提出无需多加装置,只需将原来烧杯中的AgNO3溶液换成其他溶液。你认为可将溶液换成__________________________,如果观察到_______________________________________的现象,则证明制Cl2时有HCl挥发出来。
要配制450mL 0.2mol·L-1FeSO4溶液,实验操作步骤有:①在天平上称取a g绿矾(FeSO4·7H2O),将它放在烧杯中,用适量蒸馏水使其完全溶解 ②将所得溶液沿玻璃棒注入500mL容量瓶中③继续向容量瓶中加水至液面距刻度线1~2cm处,改用胶头滴管滴加蒸馏水至凹液面底部与刻度线相切④用少量水洗涤烧杯和玻璃棒2~3次,每次洗液都转入容量瓶⑤将容量瓶塞紧,充分摇匀
填写下列空白
⑴a g绿矾的实际质量为____________g。
⑵上述操作步骤的正确顺序为__________________。
⑶下列操作会使所配溶液的浓度偏高的是__________
| A.若配制时遗漏步骤④; | B.定容时俯视刻度线; |
| C.称量时物、码放反了; | D.绿矾样品已部分风化 |
E.摇匀后溶液低于刻度线,再加入蒸馏水使液面最低点与刻度线相切;
F.引流时玻璃棒靠在刻度线上方
⑷若加蒸馏水时不慎超过刻度线,处理方法是________________;
若操作步骤②时有溶液溅在容量瓶外,处理方法是__________________。