三氯化磷(PCl3)是一种重要的有机合成催化剂。实验室常用红磷与干燥的Cl2制取PCl3,装置如下图所示。
已知:红磷与少量Cl2反应生成PCl3,与过量Cl2反应生成PCl5。PCl3遇O2会生成POCl3(三氯氧磷), POCl3溶于PCl3,PCl3遇水会强烈水解生成H3PO3和HCl。PCl3、POCl3的熔沸点见下表。
| 物质 |
熔点/℃ |
沸点/℃ |
| PCl3 |
-112 |
75.5 |
| POCl3 |
2 |
105.3 |
请答下面问题:
(1)B中所装试剂是 ,F中碱石灰的作用是 。
(2)实验时,检查装置气密性后,向D装置的曲颈甑中加入红磷,打开K3通入干燥的CO2,一段时间后,关闭K3,加热曲颈甑至上部有黄色升华物出现时通入氯气,反应立即进行。通干燥CO2的作用是 ,
(3)实验制得的粗产品中常含有POCl3、PCl5等。加入红磷加热除去PCl5后,通过 (填实验操作名称),即可得到较纯净的PCl3。
(4)C装置中的K1、K2的设计也出于类似的目的,为了达到这一实验目的,实验时与K1、K2有关的操作是 。
(5)实验后期关闭K1,打开K2,将气体通入C装置中发生反应,反应后的溶液为X。某同学设计实验来确定溶液X中含有的某些离子,请补充完成实验步骤和现象。
| 实验步骤 |
实验现象 |
实验结论 |
| ① |
|
溶液X中含有Na+ |
| ② |
|
溶液X中含有Cl- |
(5)玻璃管之间的连接需要用到胶皮管,连接的方法是:先把 ,然后稍稍用力即可把玻璃管插入橡皮管。甲同学将装置A的示意图画成右图,该示意图中明显的错误是 。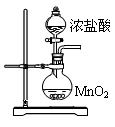
实验室用下图所示的装置制取乙酸乙酯。
(1)乙醇中含有的官能团名称为:_______;
乙酸中含有的官能团名称为:_______;
(2)浓硫酸的作用是
①_____________________;②____________________________。
(3)饱和Na2CO3溶液的作用____________________________________。
(4)实验生成的乙酸乙酯,其密度比水__________(填“大”或“小”),有__________气味。
中学实验室用如图所示装置制取少量溴苯。请填写下列空白。
(1)在烧瓶a中装的试剂是苯、溴和铁屑。导管b的作用有两个:一是导气,二是兼起__________的作用。
(2)反应过程中在导管c的下口附近可以观察到白雾出现,这是由于反应生成的________遇水蒸气而形成的。
(3)反应完毕后,向锥形瓶d中滴入AgNO3溶液,有__________生成。
(4)反应完毕后,将烧瓶a中的液体倒入盛有冷水的烧杯里,可以观察到烧杯底部有__________色不溶于水的液体。这是溶解了__________的粗溴苯。
(5)写出烧瓶a中发生反应的化学方程式:__________________________________。
某化学小组采用类似制乙酸乙酯的装置(如图),以环己醇制备环己烯。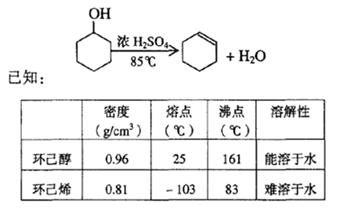

(1)制备粗品将12.5 mL环己醇加入试管A中,再加入l mL浓硫酸,摇匀后放入碎瓷片,缓慢加热至反应完全,在试管C内得到环己烯粗品。
① A中碎瓷片的作用是__________,导管B除了导气外还具有的作用是____________
② 试管C置于冰水浴中的目的是______________________________________________
(2)制备精品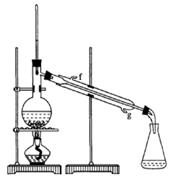
① 环己烯粗品中含有环己醇和少量酸性杂质等。加入饱和食盐水,振荡、静置、分层,环己烯在_____层(填:上、下),分液后用洗涤。
a.KMnO4溶液 b.稀H2SO4 c.Na2CO3溶液
② 再将环己烯按右图装置蒸馏,冷却水从_____口(填g或f)进入。
③ 收集产品时,控制的温度应在_____左右,实验制得的环己烯精品质量低于理论产量,可能的原因是
a.蒸馏时从70℃开始收集产品
b.环己醇实际用量多了
c.制备粗品时环己醇随产品一起蒸出
(3)以下区分环己烯精品和粗品的方法,合理的是_____
a.用酸性高锰酸钾溶液 b.用金属钠 c.测定沸点
药用有机物A为一种无色液体.从A出发可发生如下一系列反应
请回答:
(1)写出化合物F结构简式: 。
(2)写出反应①的化学方程式:
。
(3)写出反应④的化学方程式:
。
(4)有机物A的同分异构体甚多,其中属于羧酸类的化合物,且含有苯环结构的异构体
有种
(5)E的一种同分异构体H,已知H可以和金属钠反应放出氢气,且在一定条件下可发生银镜反应.试写出H的结构简式: 。
E的另一种同分异构体R在一定条件下也可以发生银镜反应,但不能和金属钠反应放出氢气.试写出R的结构简式: 。
某化学兴趣小组为探索铜跟浓硫酸的反应,用下图所示装置进行有关实验。请回答: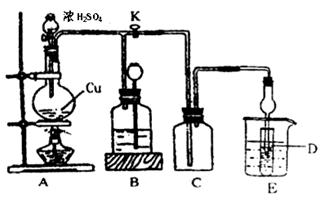
I.实验中甲同学取a 克 Cu 片和12ml 18mol/L浓H2SO4放人圆底烧瓶中加热,直到反应完毕,最后发现烧瓶中还有一定量的H2SO4和Cu剩余。
(1)请写出Cu与浓H2SO4反应的化学方程式:。
装置E中试管D内盛品红溶液,当C中气体集满后,D中有可能观察到的现象是__________。
实验装置D有可能造成环境污染,试用最简单方法加以解决(实验用品自选)_________。
(2)装置B的作用是贮存多余的气体。当D处有明显现象后,关闭旋塞K,移去酒精灯,但由于余热的作用,A处仍有气体产生进入B,B中应放置的液体(填字母):________
A.饱和Na2SO3溶液 B.酸性 KMnO4溶液
C.浓溴水 D.饱和NaHSO3溶液
(3)问题讨论:为什么有一定量的余酸但未能使Cu完全溶解呢?
足量下列药品能够用来证明反应结束后的烧瓶中的确有余酸的是_________。
A.Fe粉 B.BaCl2溶液 C.Ag D.饱和NaHSO3溶液
(4)实验中甲学生向A中反应后溶液中通入一种常见气体单质,使铜片全部溶解且仅生成硫酸铜溶液,请问该气体单质是___(填名称),反应方程式是______。