某化学兴趣小组为探索铜跟浓硫酸的反应,用下图所示装置进行有关实验。请回答: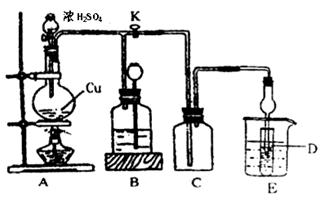
I.实验中甲同学取a 克 Cu 片和12ml 18mol/L浓H2SO4放人圆底烧瓶中加热,直到反应完毕,最后发现烧瓶中还有一定量的H2SO4和Cu剩余。
(1)请写出Cu与浓H2SO4反应的化学方程式: 。
装置E中试管D内盛品红溶液,当C中气体集满后,D中有可能观察到的现象是__________。
实验装置D有可能造成环境污染,试用最简单方法加以解决(实验用品自选)_________。
(2)装置B的作用是贮存多余的气体。当D处有明显现象后,关闭旋塞K,移去酒精灯,但由于余热的作用,A处仍有气体产生进入B,B中应放置的液体(填字母):________
A.饱和Na2SO3溶液 B.酸性 KMnO4溶液
C.浓溴水 D.饱和NaHSO3溶液
(3)问题讨论:为什么有一定量的余酸但未能使Cu完全溶解呢?
足量下列药品能够用来证明反应结束后的烧瓶中的确有余酸的是_________。
A.Fe粉 B.BaCl2溶液 C.Ag D.饱和NaHSO3溶液
(4)实验中甲学生向A中反应后溶液中通入一种常见气体单质,使铜片全部溶解且仅生成硫酸铜溶液,请问该气体单质是___ (填名称),反应方程式是______ 。
电解原理在化学工业中有广泛应用。下图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题:
(1)若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则
①电解池中X极上的电极反应式为 。
在X极附近观察到的实验现象是 。
②Y电极上的电极反应式为 。
(2)如要用电解方法精炼粗铜,电解液a选用CuSO4溶液,则:
①X电极的材料是 ,电极反应式为 。
②Y电极的材料是 ,电极反应式为 。(说明:杂质发生的电极反应不必写出)
电解一段时间后,CuSO4溶液的浓度将 (填“变大”、“变小”或“不变”)
根据下图所示装置回答问题:
(1)装置A中a电极的电极反应式为 ,b电极的电极反应式为 ;
(2)装置B中C为 极,电极反应式为 。
(3)当铁电极的质量变化为19.2g时,a极上消耗O2在标准状况下的体积为 L。
(4)当装置A中消耗0.05mol氢气时,装置B中溶液的pH为 。(溶液体积为100mL不变)
(5)若将装置B改为电解精炼铜,则粗铜作 极,另一极反应为 。
下图甲池和乙池中的四个电极都是惰性材料,乙池溶液分层,上层溶液为盐溶液,呈中性,请根据图示回答下列问题:
(1)通入乙醇(C2H5OH)的惰性电极的电极反应式为 。
若甲池可以充电,充电时A接电源的负极,此时B极发生的电极反应式为 。
(2)在乙池反应过程中,可以观察到 电极周围的溶液呈现棕褐色,反应完毕后,用玻璃棒搅拌溶液,则下层溶液呈现紫红色,上层接近无色,C极发生的电极反应 。
(3)若在常温常压下,1gC2H5OH燃烧生成CO2和液态H2O时放出29.71kJ热量,表示该反应的热化学方程式为 。
按下图所示装置进行实验,并回答下列问题:
(1)锌极为________极,电极反应式为 ;
铜极为________极,电极反应式为 ;
(2)石墨棒C1为________极,电极反应式为 ;
石墨棒C2附近发生的实验现象为 。
(3)当C2极析出224 mL气体(标准状况)时,锌的质量 (填“增加”或“减少”) g;
CuSO4溶液的质量 (填“增加”或“减少”) g。
工业上SnSO4是一种重要的硫酸盐,广泛应用于镀锡工业,其制备路线如下: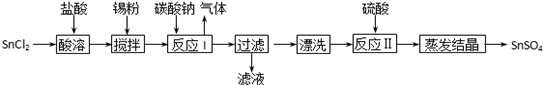
提示:①已知在酸性条件下,锡在水溶液中有Sn2+、Sn4+两种主要存在形式。
②已知Ksp[Sn(OH)2] =1.0×10-26
回答下列问题:
(1)SnCl2用盐酸而不用水直接溶解的原因是_____,加入Sn粉的作用是____。
(2)反应I生成的沉淀为SnO,写出该反应的离子方程式_______________。
(3)检验沉淀已经“漂洗”干净的方法__________________________。
(4)反应Ⅱ硫酸的作用之一是控制溶液的pH,若溶液中c(Sn2+)=1.0mol•L-1,则应控制溶液pH______。
(5)酸性条件下,SnSO4还可以用作双氧水去除剂,请写出发生反应的离子方程式________。