用含少量铁的氧化物的氧化铜制取氯化铜晶体(CuCl2·xH2O)。有如下操作:
已知:在pH为4~5时,Fe3+几乎完全水解而沉淀,而此时Cu2+却几乎不水解。
(1)溶液A中的金属离子有Fe3+、Fe2+、Cu2+。能检验溶液A中Fe2+的试剂为 (填编号,下同)
①KMnO4 ②(NH4)2S ③NaOH ④KSCN
(2)氧化剂可选用 。
①Cl2 ②KMnO4 ③HNO3 ④H2O2
(3)要得到较纯的产品,试剂可选用 。
①NaOH ②FeO ③CuO ④Cu(OH)2 ⑤Cu2(OH)2CO3
(4)欲测定溶液A中的Fe2+的浓度,实验前,首先要配制一定物质的量浓度的KMnO4溶液250mL,配制时需要的仪器除天平、玻璃棒、烧杯、药匙、胶头滴管外,还需 ,下列滴定方式中(夹持部分略去),最合理的是 (填序号)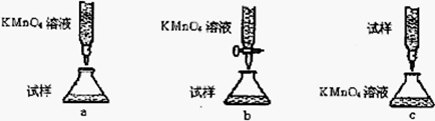
写出滴定反应的离子方程式___ __。
(5)为了测定制得的氯化铜晶体(CuCl2·xH2O)中 的值,某兴趣小组设计了两种实验方案:(已知CuCl2的摩尔质量为135g/mol;H2O的摩尔质量为18g/mol)。
的值,某兴趣小组设计了两种实验方案:(已知CuCl2的摩尔质量为135g/mol;H2O的摩尔质量为18g/mol)。
方案一:称取m g晶体灼烧至质量不再减轻为止,冷却、称量所得无水CuCl2的质量为n1 g。
方案二:称取m g晶体溶于水,加入足量氢氧化钠溶液、过滤、沉淀洗涤后用小火加热至质量不再轻为止,冷却,称量所得固体的质量为n2 g。
试评价上述两种实验方案:其中正确的方案是 ,据此计算得x= (用含m、n1或n2的代数式表示)。
(6)某同学想利用氯化钠设计一套实验装置来电解饱和食盐水,并检验氯气的氧化性和测定所产生的氢气的体积(约8mL)。
试从上图中选用几种必要的仪器,连成一整套装置,各种仪器接口的连接顺序(填编号)是:
A接 , 接 ;B接 , 接 ;
(7)若装入的饱和食盐水为75mL(氯化钠足量,电解前后溶液体积变化可忽略,假设两极产生的气体全部逸出),当测得氢气为8.4mL(标准状况)时停止通电。将U形管内的溶液倒入烧杯,其pH约为 。
(12分)X、Y和W为原子序数依次递增的短周期元素,X和Y同主族,Y的氢化物和W的氢化物具有相同的电子数。在中学范围内X的单质只有氧化性,且是空气的主要成份之一。
(1)写出实验室制取W2反应的离子方程式 。
(2)某小组设计如图所示的装置,分别研究YX2和W2的性质。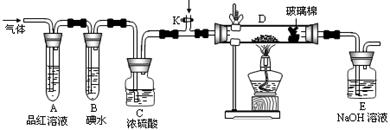
①分别通入YX2和W2,在装置A中观察到的现象是否相同 (填“相同”或“不相同”);若装置D中装的是铁粉,当通入足量W2时观察到的现象为 ;若装置D中装的是五氧化二钒(作催化剂),当通入足量YX2时,打开K通入适量X2,化学反应方程式为 ;
②若装置B中装有5.0mL 1.0×10-3mol/L的碘水,当通入足量W2完全反应后,转移了5.0×10-5mol电子,该反应的化学方程式为 。
(3)某同学将足量的YX2通入一支装有氯化钡溶液的试管,未见沉淀生成,再向该试管中加入过量的下列溶液也无沉淀生成的是 (填字母)。
| A.氨水 |
| B.稀盐酸 |
| C.稀硝酸 |
| D.氯化钙 |
E.双氧水
F.硝酸银
用18.4mol/L的浓H2SO4配制100mL 0.50mol/L的稀H2SO4,请按要求填空(每空 1分,共计 10分)
(1)用量筒量取所需浓H2SO4的体积为 mL;
(2)如果实验室有10mL、20mL、50mL量筒,应选用 mL量筒,实验中还需要用到的仪器有 、 、烧杯、玻璃棒。
(3)若实验中出现下列现象对所配溶液浓度有什么影响?(填偏高、偏低、无影响)
①浓硫酸溶解后未冷至室温即进行定容
②定容时俯视刻度线
③容量瓶洗净后未干燥 ;
④摇匀后发现液面低于刻度线后加水至溶液的凹液面与刻度线相平 ;
⑤用量筒量取浓H2SO4时仰视刻度线: 。
(4)若定容时液面高于刻度线应采取的措施是 。
某同学探究二氧化硫与BaCl2溶液、Ba(OH)2溶液反应的实验。
(1)少量SO2通入到Ba(OH)2溶液中的离子反应方程式为__________________________,过量的SO2通入到Ba(OH)2溶液中的离子反应方程式为_________________________。
(2)此同学将SO2通入到BaCl2溶液中,出现了异常现象,看到了明显的白色沉淀,为探究该白色沉淀的成分,他设计了如下实验流程: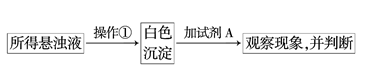
则操作①的名称为____________,试剂A的化学式为____________.
(3)实验表明,此同学加入试剂A后,白色沉淀未见溶解,则该白色沉淀的成分是__________(填化学式),则产生该白色沉淀的离子方程式是________________________。
某学校化学学习小组为探究二氧化氮的性质,按下图所示装置进行实验。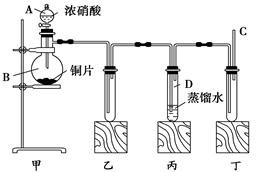
请回答下列问题:
(1)装置甲中盛放浓硝酸的仪器A的名称是________,该装置中发生反应的化学方程式______________。
(2)实验过程中,装置乙、丙中出现的现象分别是_________________________、____________________;
装置丙中的试管内发生反应的离子方程式为:____________________________________。
(3)为了探究NO的还原性,可以在装置丁的导气管C中通入一种气体,通入的这种气体的名称是______________________________。
(4)取下装置丙中的试管D,在其中滴加FeSO4溶液,溶液变为________色,为了证明铁元素在该反应中的产物,可以再在溶液中滴加KSCN溶液,溶液变为________色。
某研究性实验小组欲验证浓硝酸在与Cu、Ag合金的反应过程中除生成NO2气体外,还会有少量NO生成、并测定Cu、Ag合金中Cu的质量分数。查阅相关资料表明:“常温下,NO2与N2O4混合存在,在低于0℃时几乎只有无色的N2O4液体或晶体存在。”为此,他们设计了如下图所示的装置。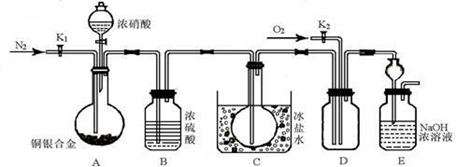
请回答下列问题
(1)写出A中Cu与HNO3反应可能的化学方程式 。
(2)实验开始前先打开A部分的活塞K1,持续通入一段时间的氮气再关闭K1,其目的是 ;装置中B瓶的作用是 。
(3)停止反应后,打开D中的活塞K2并通入O2,若有NO生成,则D中出现的现象是 ;实验发现,通入的O2温度高低对实验现象有较大影响,为便于观察应通入(填“热”或“冷”) 的O2。
(4)为减小实验误差,在A中反应完成和D中出现现象后,还应继续进行的操作是
。
(5)实验测得如下数据:实验前,Cu、Ag合金的质量:15.0g,浓HNO3:40mL 13.5 mol·L-1;实验后A溶液:V=40mL c(H+)=1.0 mol·L-1。假设反应中HNO3既无挥发也无分解,则:
①参加反应的HNO3的物质的量为 mol。
②若已测出反应后E装置的生成物中含氮元素的质量,则为确定合金中Cu的质量分数还需测定的数据是 。
(6)若已知Cu、Ag合金的质量为m g,且溶解完全。请利用A装置中反应后的溶液进行简单的操作,以确定合金中Cu的质量分数,其实验过程为 。