某研究性实验小组欲验证浓硝酸在与Cu、Ag合金的反应过程中除生成NO2气体外,还会有少量NO生成、并测定Cu、Ag合金中Cu的质量分数。查阅相关资料表明:“常温下,NO2与N2O4混合存在,在低于0℃时几乎只有无色的N2O4液体或晶体存在。”为此,他们设计了如下图所示的装置。
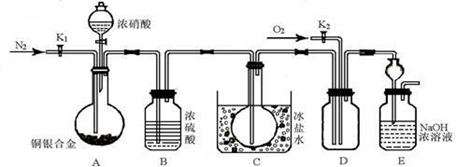
请回答下列问题
(1)写出A中Cu与HNO3反应可能的化学方程式 。
(2)实验开始前先打开A部分的活塞K1,持续通入一段时间的氮气再关闭K1,其目的是 ;装置中B瓶的作用是 。
(3)停止反应后,打开D中的活塞K2并通入O2,若有NO生成,则D中出现的现象是 ;实验发现,通入的O2温度高低对实验现象有较大影响,为便于观察应通入(填“热”或“冷”) 的O2。
(4)为减小实验误差,在A中反应完成和D中出现现象后,还应继续进行的操作是
。
(5)实验测得如下数据:实验前,Cu、Ag合金的质量:15.0g,浓HNO3:40mL 13.5 mol·L-1;实验后A溶液:V=40mL c(H+)=1.0 mol·L-1。假设反应中HNO3既无挥发也无分解,则:
①参加反应的HNO3的物质的量为 mol。
②若已测出反应后E装置的生成物中含氮元素的质量,则为确定合金中Cu的质量分数还需测定的数据是 。
(6)若已知Cu、Ag合金的质量为m g,且溶解完全。请利用A装置中反应后的溶液进行简单的操作,以确定合金中Cu的质量分数,其实验过程为 。
乙二酸俗名草酸,下面是化学学习小组的同学对草酸晶体(H2C2O4·xH2O)进行的探究性学习的过程,请你参与并协助他们完成相关学习任务。
该组同学的研究课题是:探究测定草酸晶体(H2C2O4·xH2O)中的x值。通过查阅资料和网络查寻得,草酸易溶于水,水溶液可以用酸性KMnO4溶液进行滴定:
2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O
学习小组的同学设计了滴定的方法测定x值。
①称取1.260 g纯草酸晶体,将其制成100.00 mL水溶液为待测液。
②取25.00 mL待测液放入锥形瓶中,再加入适量的稀H2SO4。
③用浓度为0.1000 mol·L-1的KMnO4标准溶液进行滴定,达到终点时消耗10.00 mL。
请回答下列问题:
(1)滴定时,将酸性KMnO4标准液装在如图中的__________(填“甲”或“乙”)滴定管中。
(2)本实验滴定达到终点的标志是_______________________。
(3)通过上述数据,求得x=________。讨论:
①若滴定终点时俯视滴定管,则由此测得的x值会________(填“偏大”、“偏小”或“不变”,下同)。
②若滴定时所用的酸性KMnO4溶液因久置而导致浓度变小,则由此测得的x值会________。
实验室用如图的仪器药品制取氯化铁粉末,已知信息:氯化铁粉末易吸水生成结晶水化合物FeCl3+6H2O=FeCl3•6H2O。
(1)按照气体流向从左到右顺序连接仪器应是(填仪器接口顺序)
接 , 接 , 接 , 接 ;
烧瓶A中反应的离子方程式是 ;
(2)仪器C名称 ,安装它的实验目的是 ,容器E作用是 ;
(3)A、B中的酒精灯应先点燃 处(填“A”或“B”)酒精灯,反应一段时间,再点燃另一个。理由是 ;
(4)这套实验装置是否完整? (填“是”或“否”),若不完整还须补充 装置(若第一问填“是”,则此问不需作答).
氮化铝(AlN)是一种新型无机非金属材料。某AlN 样品仅含有Al2O3 杂质,为测
定AlN 的含量,设计如下三种实验方案。(已知:AlN+NaOH+H2O=NaAlO2+NH3↑)
【方案l】取一定量的样品,用以下装置测定样品中AlN 的纯度(夹持装置已略去)。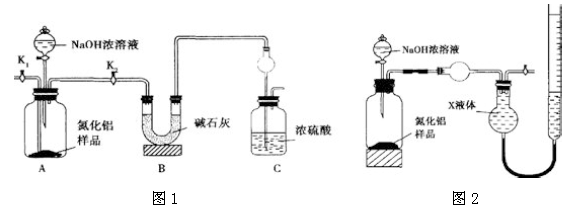
(1)图1 中球形干燥管的作用是 。
(2)完成以下实验步骤:组装好实验装置,检查装置气密性,再加入实验药品。接下来的实验操作是: 关闭K1,打开K2,打开分液漏斗活塞,加入NaOH 浓溶液,至不再产生气体。然后打开K1,通入氮气一段时间,测定C 装置反应前后的质量变化。通入氮气的目的是 。
(3)假设其他操作均正确,按照图1 装置将导致测定结果 (填“偏高”、“偏低”或“无影响”)。
【方案2】用图2 装置测定mg 样品中AlN 的纯度(部分夹持装置已略去)。
(4)为测定生成气体的体积,量气装置中的X 液体最好选择 。
a.CCl4b.H2O c.饱和NH4Cl 溶液 d.浓硫酸
(5)若m g 样品完全反应,测得生成气体的体积为VmL(已转换为标准状况)。则AlN的质量分数是 (需化简)。
【方案3】按下列路径测定样品中AlN 的纯度: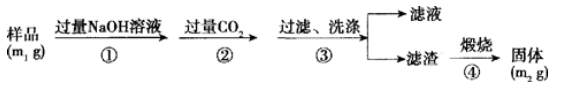
(6)写出步骤反应的离子方程式 。
(7)该方案能否测出AlN 的纯度?(若能请用m1,m2 列出计算纯度的表达式) 。
实验室要用Na2CO3·10H2O晶体配制500 mL 0.1 mol·L-1 Na2CO3溶液,回答下列问题:
(1)应该用托盘天平称取Na2CO3·10H2O____________g。
(2)如图Ⅰ表示10 mL量筒中液面的位置,A与B,B与C刻度间相差1 mL,如果刻度A为8,量筒中液体的体积是____________mL。
(3)若实验中如图Ⅱ所示的仪器有下列情况,对配制溶液的浓度有何影响?(填“偏高”、“偏低”或“无影响”)
A.定容前容量瓶底部有水珠______________________________________;
B.定容时加水超过刻度线________________________________________;
C.最终定容时俯视观察液面 。
下述实验操作与预期实验目的或所得实验结论不一致的是
| 编号 |
实 验 操 作 |
实验目的或结论 |
| A |
将SO2气体通入紫色石蕊试液中,观察溶液是否褪色 |
证明SO2有漂白性 |
| B |
向试管中加入等体积的0.005mol/L的FeCl3溶液和0.01mol/L的KSCN溶液,再滴加几滴饱和FeCl3溶液,观察颜色变化 |
探究增大反应物浓度时平衡移动的方向 |
| C |
将装有NO2和N2O4气体的联通球,一个置于冰水中,一个置于热水中,观察颜色变化 |
探究温度对化学平衡的影响 |
| D |
将CO2通入Na2SiO3水溶液观察是否有沉淀产生 |
探究碳和硅两元素非金属性强弱 |