实验室需要用NaOH固体配制0.1mol/LNaOH溶液450mL和用浓硫酸配制0.5mol/L的硫酸溶液500mL。根据这两种溶液的配制情况回答下列问题。
(1)在下图所示仪器中,配制上述溶液肯定不需要的是_________(填序号),除图中已有仪器外,配制上述溶液还需要的玻璃仪器是 。
(2)在容量瓶的使用方法中,下列操作不正确的是____________
| A.容量瓶洗涤后残留少量水不影响使用 |
| B.容量瓶用水洗净后,再用待配溶液洗涤 |
| C.配制NaOH溶液时,如果试样是固体,把称好的固体用纸条小心倒入容量瓶中,缓慢加水至接近刻度线1~2cm处,用胶头滴管加蒸馏水至刻度线。 |
| D.配制硫酸溶液时,若试样是液体,用量筒取样后用玻璃棒引流倒入容量瓶中,缓慢加水至刻度线1~2cm处,用胶头滴管加蒸馏水至刻度线。 |
E.盖好瓶塞,用食指顶住瓶塞,另一只手托住瓶底,把容量瓶反复倒转多次摇匀。
(3)用托盘天平称取NaOH的质量为 g。在实验中其他操作均正确,若定容时仰视刻度线,则所得溶液浓度 0.1mol/L(填“大于”“小于”或“等于”)。
(4)根据计算得知,需用量筒量取质量分数为98%、密度为1.84g/cm3的浓硫酸的体积为 mL(保留到小数点后1位。),若实验室有15mL、20mL、50mL量筒,应选用 mL量筒最好。
(10分,每空1分)实验室制乙烯的反应原理为CH3CH2OH  CH2===CH2↑+H2O,制取时常因温度过高而发生副反应,使部分乙醇跟浓硫酸反应生成二氧化硫、二氧化碳、水蒸气和炭黑。
CH2===CH2↑+H2O,制取时常因温度过高而发生副反应,使部分乙醇跟浓硫酸反应生成二氧化硫、二氧化碳、水蒸气和炭黑。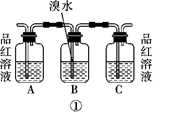


(1)请用图中编号为①、②、③、④的装置设计一个实验,以验证上述反应混合气体中含有CO2、SO2和水蒸气。用装置的编号表示装置的连接顺序(按产物气流从左到右):
→→→。
(2)实验时装置①中A瓶的现象是 ,原因是 。
B瓶中的现象是,B瓶溶液的作用是。
若C瓶中品红溶液不褪色,说明。
(3)装置③中加的固体药品是,以验证混合气体中有。装置②中盛的溶液是 ,以验证混合气体中的。
下图所示装置为铜跟浓硫酸反应制取二氧化硫的实验装置,请回答下列问题:
Ⅰ.(1)在装置A中放入有关药品后,打开活塞K,将分液漏斗中的液体加入烧瓶中,关闭分液漏斗的活塞,点燃酒精灯,烧瓶中反应的化学方程式为:___________________。
(2)装置D中试管口放置的棉花中应浸有一种液体,这种液体是,其作用是___________________。
(3)装置B的作用是贮存多余的二氧化硫和防止其污染环境,则B中应盛放的液体是(填写字母代号)
a.水 b.浓溴水 c.KMnO4酸性溶液 d.NaHSO3饱和溶液
Ⅱ.为了验证木炭和浓H2SO4反应生成了SO2和CO2,有人设计了以下实验。
(提示:酸性高猛酸钾溶液可把SO2氧化成H2SO4, 试剂可以重复使用)
(4)各装置中盛放的试剂是(填序号):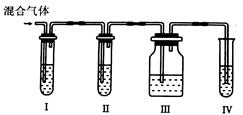
Ⅰ_______ Ⅱ_______ Ⅲ_______ Ⅳ_______
| A.品红溶液 | B.NaOH溶液 | C.澄清石灰水 | D.高锰酸钾溶液 |
(5)能说明SO2存在的现象是__________________________________________。
(6)使用装置Ⅱ的目的是______________________________________________。
(7)使用装置Ⅲ的目的是。
(8)确认含有CO2的现象是。
Ⅰ.某实验小组对H2O2的分解做了如下探究。下表是该实验小组研究影响H2O2分解速率的因素时记录的一组数据,将质量相同但状态不同的MnO2分别加入盛有15 ml 5%的H2O2溶液的大试管中,并用带火星的木条测试,结果如下:
| MnO2 |
触摸试管情况 |
观察结果 |
反应完成所需的时间 |
| 粉末状 |
很烫 |
剧烈反应,带火星的木条复燃 |
3.5 min |
| 块状 |
微热 |
反应较慢,火星红亮但木条未复燃 |
30 min |
(1)写出大试管中发生反应的化学方程式:,该反应是反应(填放热或吸热)。
(2)实验结果表明,催化剂的催化效果与有关。
Ⅱ.某可逆反应在某体积为5L的密闭容器中进行,在从0—3分钟各物质的量的变化情况如图所示(A,B,C均为气体)。
(3)该反应的的化学方程式为;
(4)反应开始至2分钟时,B的平均反应速率为。
(5)能说明该反应已达到平衡状态的是。
a.v(A)= 2v(B)
b.容器内压强保持不变
c.2v逆(A)= v正(B)
d.容器内混合气体的密度保持不变
(6)在密闭容器里,通入a mol A (g)、b mol B (g)、c molC(g),发生上述反应,当改变下列条件时,反应速率会减小的是。
A.降低温度B.加入催化剂C.增大容器体积
Ⅲ.(7)为了减缓Zn与盐酸产生氢气的反应速率而又不减少产生氢气的量,在盐酸中分别加入下列物质:
A.H2O
B.NaCl溶液
C.Na2CO3溶液
D.Cu粉
E.CuSO4粉末
你认为可行的是(填编号)。
某研究性学习小组设计实验验证氨气与二氧化硫的性质。请你完成下列研究:
(一)氨气性质探究
(1)实验室制备氨气,下列方法中可选用的是(填编号)
①加热浓氨水;②固体生石灰中滴加浓氨水;③固态氯化铵加热分解;④固态硝酸铵加热分解;
(2)该小组成员设计实验探究氨气还原性及产物,提供实验装置如下:
(3)请你根据提供的装置从左至右连接接口序号()()()()()()
(4)该装置在设计上有一定的缺陷,为确保实验结果的准确性,你对该装置的改进措施是________________;
(5)利用改进后的装置进行实验,观察到CuO全部变为红色物质,无水CuSO4变蓝,同时生成一种无污染的气体。请写出NH3与CuO反应的化学方程式________________;
(6)装置B的作用是:________________;
(二)二氧化硫性质探究
下图是实验室制取SO2并验证SO2的某些性质的装置,试回答: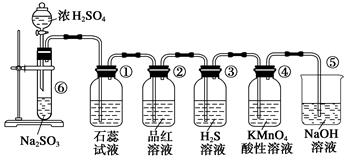
(1)盛放浓硫酸仪器的名称:_________________;
(2)若将浓硫酸改用浓硝酸能否完成此实验探究?答:____________,请写出改用浓硝酸后⑥中的离子反应方程式:_____________________________________
(3)②实验现象为:_________________,证明SO2具有________性;
(4)若③中的试剂改为Na2S溶液,实验现象与原溶液是否相同:______________,含有1mol Na2S的水溶液最多可以吸收SO2的物质的量为:________。
(5)④中发生的离子反应为:_______________________________________。
资料显示:“氨气可在纯氧中安静燃烧……某校化学小组学生设计如下装置(图中铁夹等夹持装置已略去)进行氨气与氧气在不同条件下反应的实验。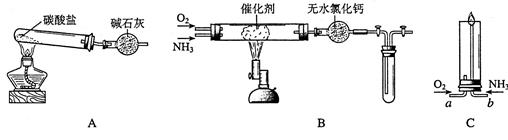
(1)用装置A制取纯净、干燥的氨气,大试管内碳酸盐的化学式是;碱石灰的作用是。
(2)将产生的氨气与过量的氧气通到装置B(催化剂为铂石棉)中,用酒精喷灯加热:
①氨催化氧化的化学方程式是试管内气体变为红棕色,该反应的化学方程式是
②停止反应后,立即关闭B中两个活塞。一段时间后,将试管浸入冰水中。试管内气体颜色变浅,请结合化学方程式说明原因
(3)将过量的氧气与A产生的氨气分别从A、B两管进气口通人到装置C中,并在B管上端点燃氨气,两气体通入的先后顺序是:先通入______(O2 ,NH3 ),后通入__________(O2,NH3)其理由是