某研究性学习小组设计实验验证氨气与二氧化硫的性质。请你完成下列研究:
(一)氨气性质探究
(1)实验室制备氨气,下列方法中可选用的是 (填编号)
①加热浓氨水;②固体生石灰中滴加浓氨水;③固态氯化铵加热分解;④固态硝酸铵加热分解;
(2)该小组成员设计实验探究氨气还原性及产物,提供实验装置如下:
(3)请你根据提供的装置从左至右连接接口序号( )( )( )( )( )( )
(4)该装置在设计上有一定的缺陷,为确保实验结果的准确性,你对该装置的改进措施是________________;
(5)利用改进后的装置进行实验,观察到CuO全部变为红色物质,无水CuSO4变蓝,同时生成一种无污染的气体。请写出NH3与CuO反应的化学方程式________________;
(6)装置B的作用是:________________;
(二)二氧化硫性质探究
下图是实验室制取SO2并验证SO2的某些性质的装置,试回答: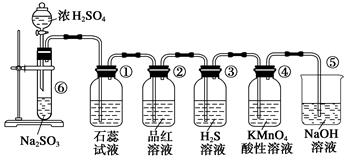
(1)盛放浓硫酸仪器的名称:_________________;
(2)若将浓硫酸改用浓硝酸能否完成此实验探究?答:____________,请写出改用浓硝酸后⑥中的离子反应方程式:_____________________________________
(3)②实验现象为:_________________,证明SO2具有________性;
(4)若③中的试剂改为Na2S溶液,实验现象与原溶液是否相同:______________,含有1mol Na2S的水溶液最多可以吸收SO2的物质的量为:________。
(5)④中发生的离子反应为:_______________________________________。
海洋约占地球表面积的71%,海水中化学资源的利用具有非常广阔的前景。
(1)目前世界上60%的镁是从海水中提取的,其主要步骤如下:
① 试剂①宜选用石灰乳且必须过量,过量的目的是.
② 镁蒸气宜在(填序号)气体冷却后得到镁锭
| A.N2 | B.CO2 | C.Ar | D.空气) |
(2)工业以浓缩海水为原料提取溴的部分过程如下: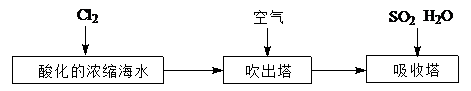
某课外小组在实验室模拟上述过程设计以下装置进行实验(所有橡胶制品均已被保护,夹持装置已略去):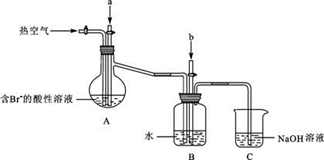
③A装置中通入a气体时,反应的离子方程式表示为:.
④A装置中通入a气体一段时间后,
停止通入,改通热空气。通入热空气的目的是:.
⑤反应过程中,B装置中产生的两种主要阴离子为.
⑥C装置的作用是。
实验室由废铜屑制胆矾(CuSO4·5H2O)的实验流程如下:
(1)洗涤铜屑油污的试剂为5% Na2CO3溶液,这是利用了Na2CO3溶液的性.
(2)溶解铜屑一种方案是:将铜屑加入到稀硫酸与双氧水的混和液中并用30~40℃水浴加热,一段时间后,铜完全溶解,得到硫酸铜溶液。
①该反应的化学方程式为.
②反应温度不能超过40℃的原因是.
(3)由硫酸铜溶液获得胆矾的操作依次为、、过滤、洗涤、干燥。
铁是人体不可缺少的微量元素,硫酸亚铁晶体(FeSO4·7H2O)在医药上作补血剂。某课外小组测定该补血剂(每片b克)中铁元素的含量。实验步骤如下: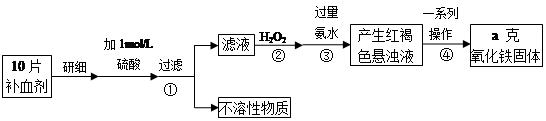
请回答下列问题:
(1)步骤②中H2O2的作用是使Fe2+完全被(填“氧化”或“还原”)为 Fe3+.
(2)步骤③所得的红褐色悬浊液中除H2O2、氨水外主要还含和(填化学式).
(3)步骤④中一系列处理的操作步骤为、洗涤、灼烧、冷却、称量.
(4)实验中用已经准确量取的浓硫酸配制100 mL 1 mol/L的硫酸溶液,则配制时用到的仪器除烧杯、玻璃棒,还有两种仪器是.
(5)若实验无损耗,则每片补血剂含铁元素的质量分数为.
(6)下列操作会导致所测定的铁元素含量偏高的是
A. 步骤③所加氨水量不足 B. 步骤④洗涤不充分 C. 步骤④灼烧不充分
(15分)碱式碳酸铜的成分有多种,其化学式一般可表示为xCu(OH)2·yCuCO3。
(1)孔雀石呈绿色,是一种名贵的宝石,其主要成分是Cu(OH)2·CuCO3。某兴趣小组为探究制取孔雀石的最佳反应条件,设计了如下实验:
实验1:将2.0mL 0.50 mol·L–1的Cu(NO3)2溶液、2.0mL 0.50 mol·L–1的NaOH溶液和0.25 mol·L–1的Na2CO3溶液按表Ⅰ所示体积混合。
实验2:将合适比例的混合物在表Ⅱ所示温度下反应。
实验记录如下:
表Ⅰ表Ⅱ
| 编号 |
V (Na2CO3)/mL |
沉淀情况 |
编号 |
反应温度/℃ |
沉淀情况 |
|
| 1 |
2.8 |
多、蓝色 |
1 |
40 |
多、蓝色 |
|
| 2 |
2.4 |
多、蓝色 |
2 |
60 |
少、浅绿色 |
|
| 3 |
2.0 |
较多、绿色 |
3 |
75 |
较多、绿色 |
|
| 4 |
1.6 |
较少、绿色 |
4 |
80 |
较多、绿色(少量褐色) |
①实验室制取少许孔雀石,应该采用的最佳条件是。
②80℃时,所制得的孔雀石有少量褐色物质的可能原因是。
(2)实验小组为测定上述某条件下所制得的碱式碳酸铜样品组成,利用下图所示的装置(夹持仪器省略)进行实验: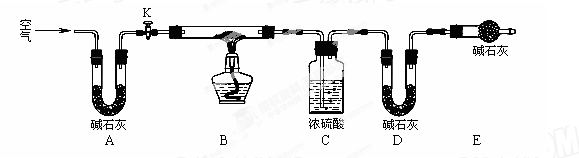
步骤1:检查装置的气密性,将过滤、洗涤并干燥过的样品置于平直玻璃管中。
步骤2:打开活塞K,鼓入空气,一段时间后关闭,称量相关装置的质量。
步骤3:加热装置B直至装置C中无气泡产生。
步骤4:(请补充该步操作内容)。
步骤5:称量相关装置的质量。
①装置A的作用是;若无装置E,则实验测定的x/y的值将。(选填“偏大”、“偏小”或“无影响”)。
②某同学在实验过程中采集了如下数据:
A.反应前玻璃管与样品的质量163.8g B.反应后玻璃管中残留固体质量56.0g
C.装置C实验后增重9.0g D.装置D实验后增重8.8g
为测定x/y的值,你认为可以选用上述所采集数据中的(写出所有组合的字母代号)任一组即可进行计算,并根据你的计算结果,写出该样品组成的化学式。
研究性学习小组对某硫酸亚铁晶体(FeSO4•xH2O)热分解研究,该小组同学称取ag硫酸亚铁晶体样品按图1高温加热,使其完全分解,对所得产物进行探究,并通过称量装置B质量测出x的值。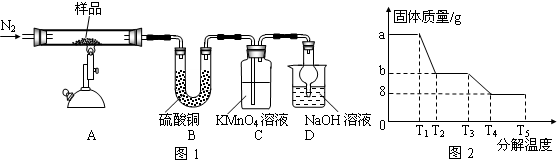
(1)装置B中硫酸铜粉末变蓝,质量增加12.6g,说明产物中有水,装置C中高锰酸钾溶液褪色,说明产物中还有。
(2)实验中要持续通入氮气,否则测出的x会(填“偏大”、“偏小”或“不变”)。
(3)硫酸亚铁晶体完全分解后装置A中还残留红棕色固体Fe2O3。
(4)从理论上分析得出硫酸亚铁分解还生成另一物质SO3,写出FeSO4分解的化学方程式。
(5)装置D球形干燥管的作用。
(6)某研究所利用SDTQ600热分析仪对硫酸亚铁晶体(FeSO4•xH2O)进行热分解,获得相关数据,绘制成固体质量——分解温度的关系图如图2,根据图2中有关数据,可计算出FeSO4•xH2O中的x
=_________________________。