(12分)为验证氧化性:Cl2>Fe3+>SO2,某小组用下图所示装置进行实验(夹持仪器和A中的加热装置已略,气密性已经检验完毕)实验过程如下:
Ⅰ.打开弹簧夹K1~K4,通入一段时间N2,再将T型导管插入B中,继续通入N2,然后关闭K1、K3、K4.
Ⅱ.打开活塞a,滴加一定量的浓盐酸,给A加热.
Ⅲ.当B中的溶液变黄时,停止加热,夹紧弹簧夹K2.
Ⅳ.打开活塞b,使约2ml的溶液流入D试管中,检验其中的离子.
V.打开弹簧夹K3、活塞c,加入70%的硫酸,一段时间后夹紧弹簧夹K3.
Ⅵ.更新试管D,重复过程Ⅳ,检验B溶液中的离子.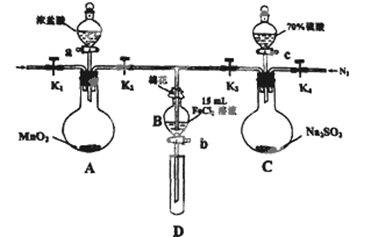
(1)过程Ⅰ的目的是______________________。
(2)棉花中浸润的溶液为__________________。
(3)A中发生反应的化学方程式为__________________________________。
(4)用70%的硫酸制取SO2,反应速率比用98%的硫酸快,原因是______________
(5)过程Ⅵ中检验B溶液中是否含有硫酸根的操作是________________________________
(6)甲、乙、丙三位同学分别完成了上述实验,他们的检测结果一定能够证明氧化性Cl2>Fe3+>SO2的是
| |
过程IV B溶液中含有的离子 |
过程VI B溶液中含有的离子 |
| 甲 |
有Fe3+无Fe2+ |
有SO42﹣ |
| 乙 |
既有Fe3+又有Fe2+ |
有SO42﹣ |
| 丙 |
有Fe3+无Fe2+ |
有Fe2+ |
通常用燃烧的方法测定有机物的分子式,可在燃烧室内将有机物样品与纯氧在电炉加热下充分燃烧,根据产品的的质量确定有机物的组成。下图所示的是用燃烧法
确定有机物物分子式的常用装置。
现准确称取0.6 g样品(只含C、H、O三种元素中的两种或三种),经燃烧后A管增重0.88 g,B管增重0.36g。请回答:
(1)按上述所给的测量信息,装置的连接顺序应是
D→ →F→ →;
(2)A、B管内均盛有有固态试剂,A管的作用是______________________;
(3)E中应盛装什么试剂:_______________;
(4)如果把CuO网去掉,A管重量将____________;(填“增大”、“减小”、或“不变”)
(5)该有机物的实验式为__________________;
(6)若该有机物低于16℃时是无色晶体,且能与碳酸氢钠反应。则其结构简式__________________。
(7)同温同压下若该有机物的密度是H2的30倍,且能发生银镜反应,写出其可能的结构简式_________________________
某化学小组以苯甲酸为原料,制取苯甲酸甲酯。已知有关物质的沸点如下表:
| 物质 |
甲醇 |
苯甲酸 |
苯甲酸甲酯 |
| 沸点/℃ |
64.7 |
249 |
199.6 |
I. 合成苯甲酸甲酯粗产品
在圆底烧瓶中加入12.2g 苯甲酸和20 mL 甲醇(密度约0.79g • mL-1) ,再小心加入3 mL 浓硫酸,混匀后,投入几粒碎瓷片,小心加热使反应完全,得苯甲酸甲酯粗产品。
(1)浓硫酸的作用是_________________________________;若反应产物水分子中有同位素18O,写出能表示反应前后18O位置的化学方程式:_________________________________________________。
(2)甲、乙、丙三位同学分别设计了如图三套实验室制取苯甲酸甲酯的装置(夹持仪器和加热仪器均已略去)。根据有机物的沸点,最好采用装置(填:甲、乙、丙)。
II. 粗产品的精制
(3)苯甲酸甲酯粗产品中往往含有少量甲醇、硫酸、苯甲酸和水等,现拟用下列流程图进行精制,请根据流程图填入恰当操作方法的名称:操作I为,操作II为。
(4)以上流程图中加入Na2CO3溶液后,放入分液漏斗中振荡、静置,要得到有机层,其具体操作是
_____________________________________________________。
(5)通过计算,苯甲酸甲酯的产率为_________________________。
某化学兴趣小组进行实验探究:探究碳、硅元素的非金属性的相对强弱。根据要求回答下列问题:
(1)实验装置: 
填写所示仪器名称A。
(2)实验步骤:
连接仪器、_____________、加药品后,打开a、然后滴入浓硫酸,加热。
(3)问题探究:(已知酸性强弱:亚硫酸>碳酸)
①铜与浓硫酸反应的化学方程式是。
装置E中足量酸性KMnO4溶液的作用是。
②能说明碳元素的非金属性比硅元素非金属性强的实验现象是。
③依据试管D中的实验现象,能否证明硫元素的非金属性强于碳元素的非金属性____。(填“能”或“否”),原因是。
用实验确定某酸HA是弱电解质。两同学的方案是:
甲:① 称取一定量的HA的配制0.1mol/L的溶液100mL;②用pH试纸测出该溶液的pH值,即可证明HA是弱电解质。
乙:① 用已知物质的量浓度的HA溶液、盐酸,分别配制pH=1的两种酸溶液各100mL;
② 分别取这两种溶液各10mL,加水稀释为100mL;
③ 各取相同体积的两种稀释液装入两个试管,同时加入纯度相同的锌粒,观察现象,即可证明HA是弱电解质。
(1)在两个方案的第①步中,都用到的定量仪器是。
(2)甲方案中,说明HA是弱电解质的理由是测得溶液的pH1(选填“>”、“<”、“=”)。
乙方案中,说明HA是弱电解质的现象是(填字母序号,多选倒扣分)。
a.装HCl的试管中放出H2的速率快;
b.装HA溶液的试管中入出H2的速率快;
c.两个试管中产生气体速率一样快。
(3)请你再提出一个合理而比较容易进行的方案(药品可任取),作简明扼要表述。
。
教材中用酸性KMnO4和H2C2O4(草酸)反应研究影响反应速率的因素,离子方程式为:2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O。一实验小组欲通过测定单位时间内生成CO2的速率,探究某种影响化学反应速率的因素,设计实验方案如下(KMnO4溶液已酸化):
实验序号 |
A溶液 |
B溶液 |
| ① |
20 mL 0.1 mol·L-1H2C2O4溶液 |
30 mL 0.01 mol·L-1KMnO4溶液 |
| ② |
20 mL 0.2 mol·L-1 H2C2O4溶液 |
30 mL 0.01 mol·L-1KMnO4溶液 |


(1) 该实验探究的是因素对化学反应速率的影响。相同时间内针筒中所得CO2的体积大小关系是- (填实验序号)。
(2)若实验①在2 min末收集了4.48 mL CO2(标准状况下),
则在2 min末,c(MnO4-)=mol/L。
(3)除通过测定一定时间内CO2的体积来比较反应速率,本实验还可通过测定来比较化学反应速率。
(4)小组同学发现反应速率总是如右图,其中t1~t2时间内速率变快的主要原因可能是:①该反应放热、②。