甲、乙两个研究性学习小组为测定氨分子中氮、氢原子个数比,设计了如下实验流程:
实验中,先用制得的氨气排尽洗气瓶前所有装置中的空气,再连接洗气瓶和气体收集装 置,立即加热氧化铜。反应完成后,黑色氧化铜转化为红色的铜。下图A、B、C为甲、乙两小组制取氨气时可能用到的装置,D为盛有浓硫酸的洗气瓶。
甲小组测得:反应前氧化铜的质量m1 g、氧化铜反应后剩余固体的质量m2g、生成氮气在标准状况下的体积V1L。乙小组测得:洗气前装置D的质量m3g、洗气后装置D的质量为m4g、生成氮气在标准状况下的体积V2L。请回答下列问题:
(1)检查A装置气密性的操作是____________________________________________________。
(2)实验室检验氨气的操作和现象是____________________________________。
(3)甲、乙两小组选择了不同的方法制取氨气,请将实验装置的字母编号和制备制备原理填写在下表的空格中。
| |
实验装置 |
实验药品 |
制备原理 |
| 甲小组 |
A |
氢氧化钙、硫酸铵 |
反应的化学方程式为____________ |
| 乙小组 |
_____ |
浓氨水、氢氧化钠 |
用化学平衡原理分析氢氧化钠的作用:_______ |
(4)甲小组用所测数据计算出氨分子中氮、氢的原子个数之比为________________。
(5)乙小组用所测数据计算出氨分子中氮、氢的原子个数之比明显小于理论值,其原因是_______。为此,乙小组在原有实验的基础上增加了一个装有某药晶的实验仪器,重新实验。根据实验前后该药品的质量变化及生成氮气的体积,得出了合理的实验结果。该药品的名称是________。
某种混合气体,可能含有N2、HCl、CO。把混合气体依次通过足量的NaHCO3溶液和灼热CuO,气体体积都没有变化。再通过足量的NaO2固体,气体体积减小。最后通过灼热的铜网,经充分反应后气体体积又减小,但还有剩余气体。以下对混合气体组成的判断,正确的是
| A.一定没有N2;CO和HCl中至少有一种 |
| B.一定有N2、HCl和CO |
| C.一定有N2;CO和HCl中至少有一种 |
| D.一定有N2和HCl;没有CO |
碳和硅的性质相似。碳的最简单的氢化物是甲烷,硅的最简单的氢化物称为甲硅烷(SiH4)。甲硅烷是一种无色无味的气体(其密度比空气大),不易溶于水,其化学性质比甲烷活泼。在实验室里制取甲硅烷的方法是:将白净细沙(SiO2)与镁粉混合起来,灼烧到反应物转变为灰黑色的硅化镁(Mg2Si)和白色的氧化镁后冷到室温;取一定量的灼烧后的残留物,置于制取甲硅烷的装置中,滴加稀盐酸后立即有甲硅烷气体逸出,并迅速地自燃。
(1)写出以上叙述中涉及的化学方程式:
①____________________________________________________________
②____________________________________________________________
③____________________________________________________________
④____________________________________________________________。
(2)制取甲硅烷的装置与制取__________ (填“H2”或“O2”)的装置相似。
(3)加入稀盐酸之前后应向密闭装置中通入氮气一会儿,其目的是__________。
(4)为研究甲硅烷的化学性质,进行了如下实验:
①将甲硅烷通入少量的硝酸银溶液中,发现有沉淀生成,后经测定知该沉淀为混合物,其中有二氧化硅。向充分反应后的溶液中滴入几滴稀盐酸,未发现有白色沉淀。向反应后的原溶液中滴入几滴碳酸钠溶液,却发现有气泡迅速放出。将甲硅烷通入硝酸银溶液中发生反应的化学方程式为___________________________________________________________________。
②制取甲硅烷后,检验装置中是否有残留的的甲硅烷的方法是__________________________。
某同学为了探究该校化学实验室的一种黑色粉末和一瓶标签破损的无色溶液,可能是什么物质,大胆猜想并设计实验进行验证。
[发现问题]当把黑色粉末与无色溶液混合时即产生气泡。[查阅资料]中学化学实验室常见的黑色粉末有氧化铜、二氧化锰、四氧化三铁、铁粉、炭粉等。
[提出假设]黑色粉末是,无色溶液是。(只写一种假设)
[设计实验]
| 实验操作 |
实验现象 |
实验结论 |
以黄铁矿为原料生产硫酸的工艺流程图如下:



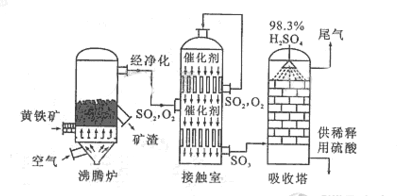



 (1)将燃烧黄铁矿的化学方程式补充完整
(1)将燃烧黄铁矿的化学方程式补充完整

 4 +11
4 +11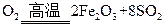

 (2)接触室中发生反应的化学方程式是 。
(2)接触室中发生反应的化学方程式是 。
 (3)依据工艺流程图判断下列说法正确的是(选填序号字母) 。
(3)依据工艺流程图判断下列说法正确的是(选填序号字母) 。
 a. 为使黄铁矿充分燃烧,需将其粉碎
a. 为使黄铁矿充分燃烧,需将其粉碎
 b. 过量空气能提高
b. 过量空气能提高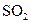 的转化率
的转化率
 c. 使用催化剂能提高
c. 使用催化剂能提高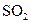 的反应速率和转化率
的反应速率和转化率
 d. 沸腾炉排出的矿渣可供炼铁
d. 沸腾炉排出的矿渣可供炼铁
 (4)每160g
(4)每160g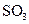 气体与
气体与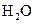 化合放出260.6kJ的热量,该反应的热化学方程是 。
化合放出260.6kJ的热量,该反应的热化学方程是 。
 (5)吸收塔排出的尾气先用氨水吸收,再用浓硫酸处理,得到较高浓度的
(5)吸收塔排出的尾气先用氨水吸收,再用浓硫酸处理,得到较高浓度的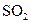 和铵盐。
和铵盐。
 ①
①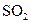 既可作为生产硫酸的原料循环再利用,也可用于工业制溴过程中吸收潮湿空气中的
既可作为生产硫酸的原料循环再利用,也可用于工业制溴过程中吸收潮湿空气中的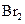 。
。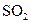 吸收
吸收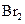 的离子方程式是 。
的离子方程式是 。
 ② 为测定该铵盐中氮元素的质量分数,将不同质量的铵盐分别加入到50.00mL相同浓度的
② 为测定该铵盐中氮元素的质量分数,将不同质量的铵盐分别加入到50.00mL相同浓度的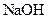 溶液中,沸水浴加热至气体全部逸出(此温度下铵盐不分解)。该气体经干燥后用浓硫酸吸收完全,测定浓硫酸增加的质量。
溶液中,沸水浴加热至气体全部逸出(此温度下铵盐不分解)。该气体经干燥后用浓硫酸吸收完全,测定浓硫酸增加的质量。
 部分测定结果;
部分测定结果;
 铵盐质量为10.00g和20.00g 时,浓硫酸增加的质量相同;铵盐质量为30.00g时,浓硫酸增加的质量为0.68g;铵盐质量为40.00g时,浓硫酸的质量不变。
铵盐质量为10.00g和20.00g 时,浓硫酸增加的质量相同;铵盐质量为30.00g时,浓硫酸增加的质量为0.68g;铵盐质量为40.00g时,浓硫酸的质量不变。
 计算:该铵盐中氮元素的质量分数是 %; 若铵盐质量为15.00g。 浓硫酸增加的质量为 。 (计算结果保留两位小数)
计算:该铵盐中氮元素的质量分数是 %; 若铵盐质量为15.00g。 浓硫酸增加的质量为 。 (计算结果保留两位小数)
以富含硫酸亚铁的工业废液为原料生产氧化铁的工艺如下(部分操作和条件略);
 I 从废液中提纯并结晶处FeSO4·7H2O。
I 从废液中提纯并结晶处FeSO4·7H2O。
 II将
II将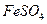 溶液与稍过量的
溶液与稍过量的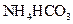 溶液混合,得到含
溶液混合,得到含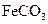 的浊液
的浊液
 IV 将浊液过滤,用90°C热水洗涤沉淀,干燥后得到
IV 将浊液过滤,用90°C热水洗涤沉淀,干燥后得到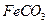 固体
固体
 V煅烧
V煅烧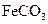 ,得到
,得到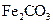 固体
固体
 已知:
已知: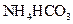 在热水中分解
在热水中分解
(1)
 I中,加足量的铁屑出去废液中的
I中,加足量的铁屑出去废液中的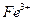 ,该反应的离子方程式是
,该反应的离子方程式是
(2)
 II中,需加一定量硫酸,运用化学平衡原理简述硫酸的作用
II中,需加一定量硫酸,运用化学平衡原理简述硫酸的作用
(3)
 III中,生成
III中,生成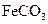 的离子方程式是 。若
的离子方程式是 。若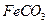 浊液长时间暴露在空气中,会有部分固体表面变为红褐色,该变化的化学方程式是 。
浊液长时间暴露在空气中,会有部分固体表面变为红褐色,该变化的化学方程式是 。
(4)
 IV中,通过检验
IV中,通过检验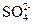 来判断沉淀是否洗涤干净。检验
来判断沉淀是否洗涤干净。检验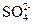 操作是是 。
操作是是 。
(5)
 已知煅烧
已知煅烧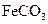 的化学方程式是
的化学方程式是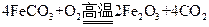 ,现煅烧464.0kg的
,现煅烧464.0kg的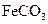 ,得到316.8kg产品,若产品中杂质只有
,得到316.8kg产品,若产品中杂质只有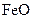 ,则该产品中
,则该产品中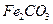 的质量是 kg(摩尔质量/g·
的质量是 kg(摩尔质量/g·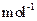 ;
;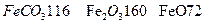 )
)