分硫代硫酸钠与稀硫酸的反应为:Na2S2O3+H2SO4=Na2SO4+S↓+SO2↑+H2O。某实验兴趣小组用如下图所示的实验装置探究外界条件对化学反应速率的影响(加热仪器和夹持仪器均已省略)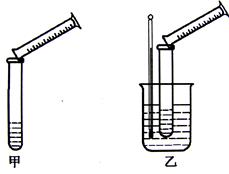
(1)实验目的:
装置甲,探究浓度对化学反应速率的影响;装置乙,探究 对化学反应速率的影响。
(2)装置乙中的加热方法称为 加热,该加热方法具有 、
等优点。
(3)通过甲、乙装置,分别进行了四组实验,数据记录如下,并经分析得出相关结论:
| 实验组号 |
温度 |
Na2S2O3 |
H2SO4 |
加入H2O 的体积 |
出现沉淀 所需时间 |
||
| 体积 |
浓度 |
体积 |
浓度 |
||||
| Ⅰ |
0OC |
5mL |
0.1mol/L |
10mL |
0.1mol/L |
5mL |
8s |
| Ⅱ |
0OC |
5mL |
0.1mol/L |
5mL |
0.1mol/L |
10mL |
12s |
| Ⅲ |
30OC |
5mL |
0.1mol/L |
5mL |
0.1mol/L |
10mL |
4s |
| Ⅳ |
30OC |
5mL |
0.2mol/L |
5mL |
0.2mol/L |
10mL |
2s |
结论1: ;
结论2: 。
襄阳五中某化学兴趣学习小组设计实验探究金属M与浓硫酸反应的气体产物。
[提出假设]假设1:气体产物只有SO2;假设2:_______________。
[实验设计]为了探究金属M与浓硫酸反应产物,设计如图实验装置:一定量的浓硫酸与金属M反应。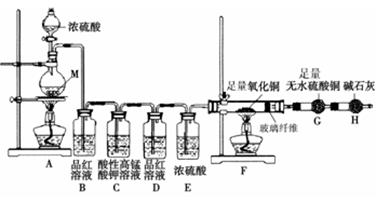
(1)检查上述装置气密性的一种方法是:关闭分液漏斗的活塞,在H装置后面连上一根导管,然后,则证明装置的气密性良好。
(2)若B瓶里品红溶液褪色,E、F和G中都无明显现象。反应后硫酸盐中金属显+2价。写A中发生反应的化学方程式:;
(3)若假设2正确,则可观察到:F管中;G干燥管里。
[实验反思] 为了进一步探究金属M成分和气体组分,进行如下实验:
称取11.2g金属M放入装置A中,加入一定量的浓硫酸,反应结束后,B瓶里品红溶液褪色,金属没有剩余,拆下G并称重,G增重0.9g。
(4)为了观察溶液颜色,实验完毕后,需要稀释烧瓶里溶液。稀释烧瓶里溶液的操作方法。
(5)将稀释后的溶液分装甲、乙试管,向甲试管里滴加KSCN溶液,溶液变红色;向乙试管里滴加酸性高锰酸钾溶液,振荡,溶液紫色褪去。如果烧瓶溶液中金属离子浓度相等,则气体成分及物质的量为。试写出烧瓶里发生反应的总化学方程式。
卤块的主要成分是MgCl2,此外还含Fe3+、Fe2+和Mn2+等离子。以卤块为原料可制得轻质氧化镁,工艺流程如下图: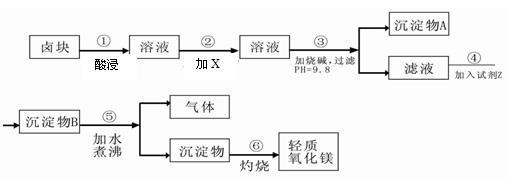
已知:Fe2+氢氧化物呈絮状,不易从溶液中除去,所以常将它氧化为Fe3+,生成Fe(OH)3沉淀除去。若要求产品尽量不含杂质,请根据表1表2提供的资料,填写空白:
表1生成氢氧化物沉淀的pH
| 试剂 |
价格(元/吨) |
| 漂液(含NaClO,25.2%) |
450 |
| 双氧水(含H2O2 ,30%) |
2400 |
| 烧碱(含98% NaOH) |
2100 |
| 纯碱(含99.5% Na2CO3) |
600 |
| 物质 |
开始沉淀 |
沉淀完全 |
| Fe(OH)3 |
2.7 |
3.7 |
| Fe(OH)2 |
7.6 |
9.6 |
| Mn(OH)2 |
8.3 |
9.8 |
| Mg(OH)2 |
9.6 |
11.1 |
表2化学试剂价格表
| 试剂 |
价格(元/吨) |
| 漂液(含NaClO,25.2%) |
450 |
| 双氧水(含H2O2,30%) |
2400 |
| 烧碱(含98%NaOH) |
2100 |
| 纯碱(含99.5%Na2CO3) |
600 |
(1)在步骤②中加入的试剂X,最佳的选择是,原因是。写出加入X发生反应的离子方程式。选择 (试剂)来检验Fe2+是否完全氧化为Fe3+
(2)在步骤③中控制pH=9.8,其目的是。
(3)试剂Z应该是。
(4)在步骤⑤中发生反应的化学方程式是。
(5)若在实验室中完成步骤⑥,则沉淀物必需在仪器A中灼烧。A应放置于仪器B上灼烧,灼烧完毕后应用仪器C取下仪器A置于仪器D上冷却。则B、C、D分别是、、。
为回收利用废钒催化剂(含有V2O5、VOSO4及不溶性残渣),科研人员最新研制了一种离子交换法回收钒的新工艺,主要流程如下: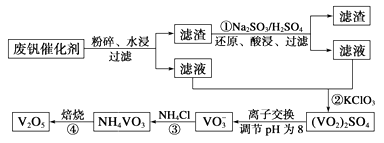
部分含钒物质在水中的溶解性如下:
| 物质 |
VOSO4 |
V2O5 |
NH4VO3 |
(VO2)2SO4 |
| 溶解性 |
可溶 |
难溶 |
难溶 |
易溶 |
回答下列问题:
(1)工业由V2O5冶炼金属钒常用铝热剂法,写出该反应的化学方程式。
(2)图中所示滤液中含钒的主要成分为(写化学式)。
(3)该工艺中反应③的沉淀率(又称沉钒率)是回收钒的关键之一,该步反应的离子方程式;沉钒率的高低除受溶液pH影响外,还需要控制氯化铵系数(NH4Cl加入质量与料液中V2O5的质量比)和温度。根据下图判断最佳控制氯化铵系数和温度为、。
(4)用硫酸酸化的H2C2O4溶液滴定(VO2)2SO4溶液,以测定反应②后溶液中含钒量,完成反应的离子方程式为VO2++H2C2O4+_____=VO2++CO2↑+H2O。
(5)全矾液流电池的电解质溶液为VOSO4溶液,电池的工作原理为VO2++V2++2H+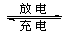 VO2++H2O+V3+,电池充电时阳极的电极反应式为。
VO2++H2O+V3+,电池充电时阳极的电极反应式为。
在航天发射时,肼(N2H4)及其衍生物常用作火箭推进剂。
(1)液态肼作火箭燃料时,与液态N2O4混合发生氧化还原反应,已知每1g肼充分反应后生成气态水放出热量为a KJ,试写出该反应的热化学方程式。
(2)实验室用N2H4·H2O与NaOH颗粒一起蒸馏,收集114~116℃的馏分即为无水肼。
①在蒸馏过程中不需要的仪器是(填序号字母)。
| A.酒精灯 |
| B.长直玻璃导管 |
| C.锥形瓶 |
| D.直型冷凝管 |
E.尾接管(接液管)
F.蒸馏烧瓶
G.滴定管
②除上述必需的仪器外,还缺少的主要玻璃仪器是。
(3)肼能使锅炉内壁的铁锈变成较为致密的磁性氧化铁(Fe3O4)层,以减缓锅炉锈蚀。若反应过程中肼转化为氮气,则每生成1molFe3O4,需要消耗肼的质量为g。
(4)磁性氧化铁(Fe3O4)的组成可写成FeO·Fe2O3。某化学实验小组通过实验来探究一黑色粉末是否由Fe3O4、CuO组成(不含有其它黑色物质)。探究过程如下:
提出假设:假设1.黑色粉末是CuO;
假设2.黑色粉末是Fe3O4;
假设3.。
探究实验:
取少量粉末放入足量稀硫酸中,在所得溶液中滴加KSCN试剂。
①若假设1成立,则实验现象是。
②若所得溶液显血红色,则假设成立。
③为进一步探究,继续向所得溶液加入足量铁粉,若产生现象,则假设3成立。
有另一小组同学提出,若混合物中CuO含量较少,可能加入铁粉后实验现象不明显。
查阅资料:Cu2+与足量氨水反应生成深蓝色溶液,Cu2++4NH3·H2O=Cu(NH3)42++4H2O。
④为探究是假设2还是假设3成立,另取少量粉末加稀硫酸充分溶解后,再加入足量氨水,若假设2成立,则产生现象;若产生现象,则假设3成立。
溴乙烷是一种重要的有机化工原料,制备溴乙烷的原料有95%乙醇、80%硫酸(用蒸馏水稀释浓硫酸)、研细的溴化钠粉末和几粒碎瓷片,该反应的原理如下:
NaBr + H2SO4 → NaHSO4 + HBr
CH3CH2OH + HBr CH3CH2Br + H2O
CH3CH2Br + H2O
某课外小组欲在实验室制备溴乙烷的装置如右图。数据如下表。
| 物质 数据 |
乙醇 |
溴乙烷 |
1,2-二溴乙烷 |
乙醚 |
浓硫酸 |
| 密度/g·cm-3 |
0.79 |
1.46 |
2.2 |
0.71 |
1.84 |
| 熔点(℃) |
-130 |
-119 |
9 |
-116 |
10 |
| 沸点(℃) |
78.5 |
38.4 |
132 |
34.6 |
338 |
| 在水中的溶解度(g/100g水) |
互溶 |
0.914 |
1 |
7.5 |
互溶 |
请回答下列问题。
(1)加入药品之前须做的操作是:_________________,实验进行的途中若发现未加入碎瓷片,其处理的方法是__________________。
(2)装置B的作用是除了使溴乙烷馏出,还有一个目的是_____________。温度计的温度应控制在_____________之间。
(3)反应时有可能生成SO2和一种红棕色气体,可选择氢氧化钠溶液除去该气体,有关的离子方程式是___________,______________,此操作可在___________(填写玻璃仪器名称)中进行,同时进行分离。
(4)实验中采用80%硫酸,而不能用98%浓硫酸,一方面是为了减少副反应,另一方面是为了________。
(5)粗产品中含有的主要有机液体杂质是_____________,为进一步制得纯净的溴乙烷,对粗产品进行水洗涤、分液,再加入无水CaCl2,进行______________操作。