为了减少煤燃烧对大气造成的污染,煤的气化和液化是高效、清洁利用煤炭的重要途径,而减少CO2气体的排放也是人类面临的重大课题。煤综合利用的一种途径如下所示:
(1)用如图[(1)小题图]所示装置定量检测过程①产生的CO2(已知:煤粉燃烧过程中会产生SO2)B中预期的实验现象是 ,D中的试剂是 。

(2)已知① C(s) + H2O(g) = CO(g) + H2 (g) ; ΔH1 =" +131.3" kJ·mol-1
② C(s) + 2H2O(g) = CO2(g) + 2H2(g) ;ΔH2 =" +90" kJ·mol-1
则一氧化碳与水蒸气反应生成二氧化碳和氢气的热化学方程式是 。
(3)用(3)小题图装置可以完成⑤的转化,同时提高能量的利用率。其实现的能量转化形式主要是由 能转化为 能,a的电极反应式是 。
(4)燃煤烟气中的CO2可用稀氨水吸收,不仅可以减少CO2的排放,也可以生产化肥碳酸氢铵。假设该方 法每小时处理含CO2的体积分数为11.2%的燃煤烟气 1000 m3(标准状况),其中CO2的脱除效率为80%,则理论上每小时生产碳酸氢铵 kg。
(15分)二氯化一氯五氨合钴([Co(NH3)5Cl]Cl2,M=250.5g·mol-1,紫红色固体)因在离子鉴定、电镀、医学方面的广泛应用受到人们的关注,它不溶于乙醇,难溶于水。实验室制备二氯化一氯五氨合钴的流程及装置如下: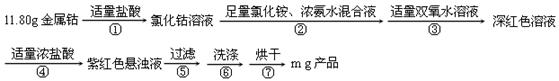

相关信息如下:Co + 2HCl ="=" CoCl2 + H2↑;[Co(NH3)5Cl]2++H2O [Co(NH3)5H2O]3+(深红色)+Cl-
[Co(NH3)5H2O]3+(深红色)+Cl-
请回答下列问题:
(1)写出仪器a的名称 ;向装置2中加入适量盐酸后,关闭活塞进行第①步反应,如何通过装置1判断该反应已经完全 ;在不添加其他试剂的前提下,如何操作能够实现第②步反应 。
(2)第③步加入双氧水的作用是 ;第④步加入适量浓盐酸的作用是 。
(3)第⑥步洗涤操作为:先用冷水洗涤,再用乙醇洗涤。其中乙醇洗涤的目的是 。
(4)第⑦步烘干操作的温度应控制在100-160℃,温度不能过低也不能过高的可能原因是 。
(5)将产品分为10等份,取其中一份于强碱溶液中,加热煮沸,蒸出所有氨气后,向溶液中加酸中和,然后加入0.5000mol·L-1的KI溶液0.04000L(过量),滴加指示剂,用0.1000mol·L-1Na2S2O3溶液滴定,达到终点消耗0.1200LNa2S2O3标准溶液,则该实验产率为 。(2Co3++2I-=2Co2++I2;2S2O32-+I2=S4O62-+2I-)
(15分)氨基甲酸铵(NH2COONH4)是一种白色固体,易分解、易水解,可用做肥料、灭火剂、洗涤剂等.某化学兴趣小组模拟制备氨基甲酸铵,反应的化学方程式如下:
2NH3(g) + CO2(g)  NH2COONH4(s)ΔH<0
NH2COONH4(s)ΔH<0
(1)如用图1装置制取氨气,你所选择的试剂是 。制备氨基甲酸铵的装置如图3所示,把氨气和二氧化碳通入四氯化碳中,不断搅拌混合,生成的氨基甲酸铵小晶体悬浮在四氯化碳中。当悬浮物较多时,停止制备。
注:四氯化碳与液体石蜡均为惰性介质。
(2)发生器用冰水冷却的原因是 。
(3)液体石蜡鼓泡瓶的作用是 。
(4)从反应后的混合物中分离出产品的实验方法是 (填写操作名称);为了得到干燥产品,应采取的方法是 (填写选项序号)。
a.常压加热烘干
b.高压加热烘干
c.真空40℃以下烘干
(5)尾气处理装置如图2所示。双通玻璃管的作用 ;浓硫酸的作用 。
(6)称取因部分变质而混有碳酸氢铵的氨基甲酸铵样品0.7820g,用足量石灰水充分处理后,使碳元素完全转化为碳酸钙,过滤、洗涤、干燥,测得质量为1.000g。则样品中氨基甲酸铵的物质的量分数为 。(精确到2位小数)
(15分)用二氧化氯(ClO2)、高铁酸钠(Na2FeO4摩尔质量为166 g·mol-1)等新型净水剂替代传统的净水剂Cl2对淡水进行消毒是城市饮用水处理新技术。ClO2和Na2FeO4在水处理过程中分别被还原为Cl-和Fe3+。
(1)如果以单位质量的氧化剂所得到的电子数来表示消毒效率,那么ClO2、Na2FeO4、Cl2三种消毒杀菌剂的消毒效率由大到小的顺序是 > > 。(填化学式)
(2)二氧化氯是一种黄绿色有刺激性气味的气体,其熔点为-59℃,沸点为11.0℃,易溶于水。工业上用稍潮湿的KClO3和草酸在60℃时反应制得。某学生用如图所示的装置模拟工业制取及收集ClO2,其中A为ClO2的发生装置,B为ClO2的凝集装置,C为尾气吸收装置。请问:
①A部分还应添加温度控制装置,请你说出一种温度控制方法 ,B部分还应补充什么装置 ;
②C中烧杯中所盛试剂为NaOH溶液,反应时生成氯酸钠和亚氯酸钠(NaClO2),发生该反应的离子方程式为 。
(3)工业也可以用CH3OH与NaClO3为原料在酸性(硫酸酸化)条件下制取ClO2,同时产生CO2气体,已知该反应分为两步进行,第一步为2ClO3-+2Cl-+4H+ ="=" 2ClO2↑+Cl2↑+2H2O。
①写出第二步反应的离子方程式 。
②工业生产时需在反应物中加少量Cl-,其作用是 。
③生产中会发生副反应ClO3-+Cl-+H+ ="=" Cl2↑+H2O(未配平),若测得反应后的混合气体中Cl2的体积分数为 ,则起始投料时CH3OH与NaClO3的物质的量之比为 。
,则起始投料时CH3OH与NaClO3的物质的量之比为 。
(4)Na2FeO4在水溶液中不稳定,一段时间后转化为红褐色沉淀,同时生产一种无色无味的单质气体,写出Na2FeO4与水反应的离子方程式 ;Na2FeO4可作为一种“绿色多功能”水处理剂的原因是 。
Ⅰ.(6分)在某盐甲的溶液中加入NaOH溶液,加热,会产生能使酚酞试液变红的气体乙;若在盐甲溶液中加入铜片和稀盐酸,则会产生无色气体,该气体遇空气变红棕色。
(1)盐甲中阳离子的电子式 。
(2)气体乙使酚酞试液变红原因是 。(用电离方程式表示)
(3)写出盐甲与铜片和稀盐酸反应的离子的方程式 。
Ⅱ.(12分)某种无机矿物的主要成分M含有五种元素,且含有结晶水。为了探究M的化学式,某化学兴趣小组做了下列实验:
(1)M的化学式为 。反应中生成红褐色沉淀的离子方程式为 。
(2)写出溶液1与过量CO2反应的离子方程式 ;实验中要将红褐色沉淀灼烧后再称量的原因是 。
(3)将白色沉淀1充分灼烧可得固体X。固体X与氯气混合加热可能发生氧化还原反应,写出一个可能的化学反应方程 ,并设计实验方案验证该反应的固体的产物 。
【化学-选修2:化学与技术】水处理技术在生产、生活中应用广泛,对工业废水和生活污水进行处理是防止水体污染、改善水质的主要措施。
(1)水的净化和软化的区别是________。
(2)①生活用水必须保证安全,自来水厂需要对取自江河湖泊中的淡水进行杀菌消毒、混凝沉淀、过滤等工艺处理,这三项处理的正确顺序是_________。
②下列试剂能够用来对自来水进行杀菌消毒,且不会造成二次污染的是_______填字母)。
a.福尔马杯 b.漂白粉 c.氯气 d.臭氧
(3)Na2FeO4是一种新型水处理剂,工业上可用FeSO4制备Na2FeO4其工艺流程如下:
①工业上常用硫酸亚铁作混凝剂除去天然水中含有的悬浮物和胶体,为了达到更好的效果,要将待处理水的pH调到9左右,再加人绿矾。请解释这一做法的原因:________________________。(用必要的离子方程式和文字描述)。
②写出由Fe(OH)3制取Na2FeO4的化学方程式:____________。
(4)石灰纯碱法是常用的硬水软化方法,已知25℃时 ,现将等体积的Ca(OH)2溶液与Na2CO3溶液混合(假设溶液体积具有加和性),若Na2CO3溶液的浓度为
,现将等体积的Ca(OH)2溶液与Na2CO3溶液混合(假设溶液体积具有加和性),若Na2CO3溶液的浓度为 ,则生成沉淀所需Ca(OH)2溶液的最小浓度为____________。
,则生成沉淀所需Ca(OH)2溶液的最小浓度为____________。