下图所示装置为铜跟浓硫酸反应制取二氧化硫的实验装置,请回答下列问题:
Ⅰ.(1)在装置A中放入有关药品后,打开活塞K,将分液漏斗中的液体加入烧瓶中,关闭分液漏斗的活塞,点燃酒精灯,烧瓶中反应的化学方程式为:___________________。
(2)装置D中试管口放置的棉花中应浸有一种液体,这种液体是 ,其作用是___________________。
(3)装置B的作用是贮存多余的二氧化硫和防止其污染环境,则B中应盛放的液体是 (填写字母代号)
a.水 b.浓溴水 c.KMnO4酸性溶液 d.NaHSO3饱和溶液
Ⅱ.为了验证木炭和浓H2SO4反应生成了SO2和CO2,有人设计了以下实验。
(提示:酸性高猛酸钾溶液可把SO2氧化成H2SO4, 试剂可以重复使用)
(4)各装置中盛放的试剂是(填序号):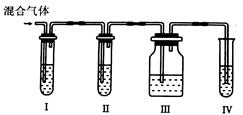
Ⅰ_______ Ⅱ_______ Ⅲ_______ Ⅳ_______
| A.品红溶液 | B.NaOH溶液 | C.澄清石灰水 | D.高锰酸钾溶液 |
(5)能说明SO2存在的现象是__________________________________________。
(6)使用装置Ⅱ的目的是______________________________________________。
(7)使用装置Ⅲ的目的是 。
(8)确认含有CO2的现象是 。
两套如图所示装置,各盛有2g锌粒(颗粒大小相同)分别加入40ml 1mol/L和40ml 4mol/L的硫酸,比较二者收集10ml H2时所用的时间。
(1)当收集到10mL H2时,哪个实验所耗时间较长?为什么?
_________________________________________________________________________________
(2)活塞外移的情况是_______________。
| A.均匀外移 | B.先快后慢 | C.先慢后快 | D.先慢后快然后又逐渐减慢 |
你选择的理由是___________________________________________________________。
同学想通过下图所示装置(夹持装置已略去)进行实验,研究推断SO2与Na2O2反应的产物。
回答下列问题:
(1)装置B的作用___________________________________________________。
装置D除了吸收过量的SO2外还有什么作用___________________________。
(2)如何检验反应中是否有O2生成______________________________________。
(3)假如Na2O2已反应完全,为确定C中固体产物的成分,甲设计如下实验:
得出结论:产物是Na2SO4.
该方案是否合理____________(填是或否),理由是_____________________-。
海带中含有丰富的碘。为了从海带中提取碘,某研究性学习小组设计并进行了以下实验:
请填写下列空白:
(1)步骤⑥的目的是从含碘苯溶液中分离出单质碘和回收苯,步骤③和步骤⑥该步骤的实验操作名称分别是是。
(2)步骤①灼烧海带时,除需要三脚架、泥三角外,还需要用到的实验仪器是
| A.烧杯 | B.表面皿 | C.坩埚 | D.酒精灯 E.干燥器 |
(3)步骤⑥是从含碘苯溶液中分离出单质碘和回收苯,还需经过蒸馏,指出下列实验装置中的错误之处。
①
②
③
(4)进行上述蒸馏操作时,使用水浴的原因是①;
最后晶态碘在②里聚集。
(5)步骤④反应的离子方程式是。
步骤④中的转化还可以Cl2或双氧水(H2O2),请分别写出反应的离子方程式:,
。
(6)步骤⑤中,某学生选择用苯来提取碘的理由是。
(7)请设计一种检验提取碘后的水溶液中是否还含有单质碘的简单方法:。
色谱分析法是现代分离实验技术中的一种,试回答下列问题:
(1)已知两种有机色素A 与B混合在一起,经测定知A的极性比B强,则下列说法正确的是_________
A. 用溶解过滤法,B不溶A溶于水
B. 用重结晶法,A在水中的溶解度比B大
C. 用蒸馏法,因为A的熔沸点高
D. 用纸层析法,丙酮为展开剂,下端为A,上端为B
(2)纸层析法的原理是_________
A.萃取原理 B. 毛细现象 C. 蒸馏原理 D. 极性相似相溶原理 E.过滤
(3)在用纸层法进行层析操作时,为什么不能让滤纸上的试样点接触展开剂?__________。
实验室制取乙酸乙酯的主要步骤如下:
①在甲试管(如图)中加入2mL浓硫酸、3mL乙醇和2mL乙酸的混合溶液.
②按右图连接好装置(装置气密性良好)并加入混合液,用小火均匀地加热3~5min。
③待试管乙收集到一定量产物后停止加热,撤出试管B并用力振荡,然后静置待分层。④分离出乙酸乙酯层、洗涤、干燥。
(1)反应中浓硫酸的作用是___________________写出制取乙酸乙酯的化学方程式:___________________________________;
(2)上述实验中饱和碳酸钠溶液的作用是(填字母):_______________。
| A.中和乙酸和乙醇。 |
| B.中和乙酸并吸收部分乙醇。 |
| C.乙酸乙酯在饱和碳酸钠溶液中的溶解度比在水中更小,有利于分层析出。 |
| D.加速酯的生成,提高其产率。 |
(3)欲将乙试管中的物质分离开以得到乙酸乙酯,必须使用的仪器有__________;分离时,乙酸乙酯应该从仪器 ________(填:“下口放” 或“上口倒”)出。