Ⅰ.某实验小组对H2O2的分解做了如下探究。下表是该实验小组研究影响H2O2分解速率的因素时记录的一组数据,将质量相同但状态不同的MnO2分别加入盛有15 ml 5%的H2O2溶液的大试管中,并用带火星的木条测试,结果如下:
| MnO2 |
触摸试管情况 |
观察结果 |
反应完成所需的时间 |
| 粉末状 |
很烫 |
剧烈反应,带火星的木条复燃 |
3.5 min |
| 块状 |
微热 |
反应较慢,火星红亮但木条未复燃 |
30 min |
(1)写出大试管中发生反应的化学方程式: ,该反应是 反应(填放热或吸热)。
(2)实验结果表明,催化剂的催化效果与 有关。
Ⅱ.某可逆反应在某体积为5L的密闭容器中进行,在从0—3分钟各物质的量的变化情况如图所示(A,B,C均为气体)。
(3)该反应的的化学方程式为 ;
(4)反应开始至2分钟时,B的平均反应速率为 。
(5)能说明该反应已达到平衡状态的是 。
a.v(A)= 2v(B)
b.容器内压强保持不变
c.2v逆(A)= v正(B)
d.容器内混合气体的密度保持不变
(6)在密闭容器里,通入a mol A (g)、b mol B (g)、c molC(g),发生上述反应,当改变下列条件时,反应速率会减小的是 。
A.降低温度 B.加入催化剂 C.增大容器体积
Ⅲ.(7)为了减缓Zn与盐酸产生氢气的反应速率而又不减少产生氢气的量,在盐酸中分别加入下列物质:
A.H2O
B.NaCl溶液
C.Na2CO3溶液
D.Cu粉
E.CuSO4粉末
你认为可行的是(填编号) 。
三草酸合铁酸钾晶体K3[Fe(C2O4)3]·3H2O可用于摄影和蓝色印刷。某小组将无水三草酸合铁酸钾在一定条件下加热分解,对所得气体产物和固体产物进行实验和探究。请利用实验室常用仪器、用品和以下限选试剂完成验证和探究过程。
限选试剂:浓硫酸、1.0 mol·L-1 硝酸、1.0 mol·L-1 盐酸、1.0 mol·L-1 NaOH溶液、3% H2O2、0.1 mol·L-1 KI溶液、0.1 mol·L-1 CuSO4溶液、20% KSCN溶液、澄清石灰水、氧化铜、蒸馏水。
(1)将气体产物依次通过(A)澄清石灰水、浓氢氧化钠(B)浓硫酸、灼热氧化铜(C)澄清石灰水;观察到(A)、(C)中澄清石灰水都变浑浊,(B)中有红色固体生成,则气体产物是。
(2)该小组同学查阅资料后推知,固体产物中,铁元素不可能以三价形式存在,而盐只有K2CO3。验证固体产物中钾元素存在的方法是。
(3)固体产物中铁元素存在形式的探究。
① 提出合理假设
假设1:;
假设2:;
假设3:。
② 设计实验方案证明你的假设
| 实验步骤 |
预期现象与结论 |
| 步骤1:取适量固体产物于试管中,加入足量蒸馏水,充分振荡使K2CO3完全溶解。分离不溶固体与溶液,用蒸馏水充分洗涤不溶固体。 |
固体部分溶解。 |
| 步骤2: |
|
| 步骤3: |
|
(4)若假设1成立,K3[Fe(C2O4)3]分解反应的化学方程式为。
实验室制取氨与氨的有关性质实验会用到如下甲、乙、丙、丁四套装置:
(1)实验室通常利用图甲所示的装置来制取氨。简述点燃酒精灯后给试管加热的操作过程__________________________________________,说明发生装置试管口略向下倾斜的原因________________________________;
(2)图乙点滴板(或玻璃片)的3个凹穴中分别滴入1滴浓盐酸、浓硝酸和浓硫酸。然后加热NH4Cl和Ca(OH)2的混合物,当有氨放出时,移动点滴板,使导管口对准不同的酸。简述观察到的主要现象________________________________;
(3)实验室利用图丙所示的装置也可制取氨,指出所用的药品为_____________ ,利用相关化学原理解释产生氨的理由______________;
(4)某学生欲用图丁装置进行喷泉实验,结果失败,试分析失败的可能原因(至少填3个要点)_____________________________________________________;
(5)若某学生用图丁装置成功进行了喷泉实验,已知烧瓶中用排空气法收集到的氨气(标准状况下)相对H2的密度为9,则理论上得到氨水的物质的量浓度约为
____________________(精确到小数点后三位)。
为测定Na2CO3与Na2SO3混合物中各组分的含量,取样品23.2g以下图所示装置进行实验:(铁架台、铁夹等仪器未在图中画出)
⑴仪器F的作用是。
⑵已知仪器C中装有品红溶液,其作用是 ,有人提出该溶液可能引起Na2CO3含量的测量结果比实际值偏低,理由是。
,有人提出该溶液可能引起Na2CO3含量的测量结果比实际值偏低,理由是。
⑶实验室中备有以下常用试剂:a.浓硫酸 b.品红溶液 c.酸性高锰酸钾溶液 d.氢氧化钠溶液 e.无水硫酸铜 f.碱石灰 g.五氧化二磷 h.无水氯化钙,请将下列容器中应盛放的试剂序号填入相应空格:B中,D中,E中。
实验过程中,当仪器A内的固体反应完全后,需打开活塞K,向A中通入大量的空气。这样做的目的是使A、B、C、D各仪器中残留的CO2进入E被充分吸收。所通空气应先经过___________试剂(填上述所供试剂的序号)处理,否则可能引起Na2SO3含量的测量结果比实际值_________(填“偏高”,“偏低”或“没影响”)。
⑷若仪器E在试验完成时增重4.4g,则Na2CO3与Na2SO3的物质的量之比为_______,其中4.4g数值获得的方法是_______________________________。
利用Y型管与其它仪器组合可以进行许多实验(固定装置略)。分析并回答下列问题:
| ⑴ |
 |
实验目的:验证SO2有氧化性 将胶头滴管中浓硫酸分别滴入Y型管的两个支管中,在支管交叉处实验现象为________________;硫化亚铁处加水的目的是___________________。 |
| ⑵ |
 |
实验目的:探究SO2与BaCl2反应产生沉淀的条件 二氧化硫通入氯化钡溶液并不产生沉淀,而通入另一种气体后可以产生白色沉淀。则右侧Y型管中应放置的药品是_________、_________(必要时可以加热),该沉淀的化学式为____________。 |
| ⑶ |
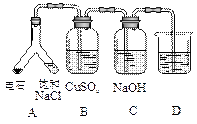 |
实验目的:探究电石气中的成分 ①装置A中的化学反应方程式为: _________________________________________。 ②B装置中出现黑色沉淀,可判断电石气中含有________;C装置的作用为__________________。 ③为验证电石气的主要成分,D中盛放________。 |
| ⑷ |
 |
实验目的:锌铁合金中铁含量的测定 ①读取量气管中数据时,若发现水准管中的液面低于量气管中液面,应采取的措施是__________ _________________________________________。 ②若称得锌铁合金的质量为0.117g,量气管中初读数为1.00mL,末读数为45.80mL,则合金中铁的质量分数为(保留2位小数,气体的体积已折算成标准状况)。 |
(16分)已知硫酸亚铁铵晶体为浅绿色,易溶于水、不溶于乙醇,在水中的溶解度比FeSO4和(NH4)2SO4都要小;能水解;具有还原性,但比硫酸亚铁稳定。
以下是将绿矾(FeSO4•7H2O)、硫酸铵以相等物质的量混合可制得摩尔盐晶体的流程图。根据下图回答: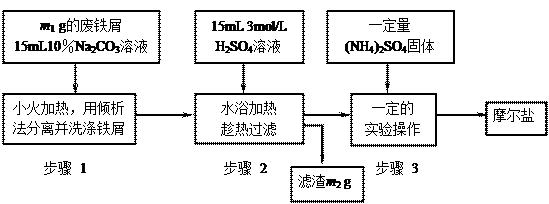
(1)为处理废铁屑表面的油污,用10%Na2CO3溶液清洗,请用离子方程式表示Na2CO3溶液呈碱性的原因: ▲。
(2)步骤1中采用倾析法分离出铁屑,下列适合用倾析法的有 ▲:
A.沉淀的颗粒较大 B.沉淀容易沉降 C.沉淀呈胶状 D.沉淀呈絮状
(3)步骤2 中铁屑过量的目的是(用离子方程式表示):▲。步骤2中溶液趁热过滤的原因是 ▲。
中铁屑过量的目的是(用离子方程式表示):▲。步骤2中溶液趁热过滤的原因是 ▲。
(4)步骤3中,加入(NH4)2SO4固体后,应 加热到 ▲时,停止加热。需经过的实验操作包括: ▲、 ▲ 、减压过滤(或抽滤)等得到较为 ▲的晶体。
加热到 ▲时,停止加热。需经过的实验操作包括: ▲、 ▲ 、减压过滤(或抽滤)等得到较为 ▲的晶体。
(5)抽滤装置的仪器有: ▲、 ▲、安全瓶、抽气泵组成。
(6)产品中Fe2+的定量分析:
制得的摩尔盐样品中往往含有极少量的Fe3+。为了测定摩尔盐产品中Fe2+的含 量,一般采用在酸性下用KMnO4标准液滴定的方法。
量,一般采用在酸性下用KMnO4标准液滴定的方法。
称取4.0 g的摩尔盐样品,溶于水,并加入适量稀硫酸。用0.2 mo1/L KMnO4溶液滴定,当溶液中Fe2+全部被氧化时,消耗KMnO4溶液体积 10.00 mL。
①请完成滴定过程中发生的离子方程式:
Fe2++MnO4-+( )="" Mn2++Fe3++H2O
②本实验的指示剂 ▲。
A.酚酞 B.甲基橙 C.石蕊 D.不需要
③KMnO4溶液置于 ▲ (酸式、碱式)滴定管中
④终点颜色的变化: ▲。
⑤产品中Fe2+的质量分数为 ▲。 (7)在25℃时,相同物质的量浓度的(NH4)2 CO3、(NH4)2SO4、摩尔盐三种盐溶液a,b,c,其铵根离子浓度由小到大的排列顺序为: ▲。(用a,b,c回答)
(7)在25℃时,相同物质的量浓度的(NH4)2 CO3、(NH4)2SO4、摩尔盐三种盐溶液a,b,c,其铵根离子浓度由小到大的排列顺序为: ▲。(用a,b,c回答)