(10分)
为测定氯化钾和硫酸钾混合物中氯化钾的含量,某同学设计了如下实验:称量样品, 溶解,添加适量A溶液,过滤,得沉淀和滤液B,将沉淀洗涤,烘干,得物质C。
溶解,添加适量A溶液,过滤,得沉淀和滤液B,将沉淀洗涤,烘干,得物质C。
回答下列问题:
(1)溶液A溶质的化学式_____,物质C的化学式____。
(2)用托盘天平称量样品,当天平平衡时,发现左盘错放砝码质量为26g,游码为0.4g,则右盘样品实际质量是____。
(3)若过滤使用的仪器和用品已有:滤纸、铁架台、铁圈、烧杯、漏斗,还需要补充的仪器或用品是______。
(4)若C的质量为23.3g,则原混合物中氯化钾的质量分数为______。
下列实验操作不正确的是(填字母代号)。
| A.在催化剂存在的条件下,苯和溴水发生反应可生成无色、比水重的液体溴苯。 |
| B.将铜丝弯成螺旋状,在酒精灯上加热变黑后,立即伸入盛有无水乙醇的试管中,完成乙醇氧化为乙醛的实验。 |
| C.醇中含有少量水可加入生石灰再蒸馏制得无水乙醇。 |
| D.验证蔗糖的水解产物时,将蔗糖和稀H2SO4溶液混合,水浴加热使其充分水解,然后用稀的NaOH溶液使其呈碱性后,再滴加银氨溶液。 |
F.验证溴乙烷水解产物时,将溴乙烷和氢氧化钠溶液混合,充分振荡溶液、静置、待液体分层后,滴加硝酸银溶液。
G.实验室蒸馏石油时温度计水银球插入石油中测量温度,收集60℃~150℃馏分得到汽油。
用50 mL 0.50 mol/L的盐酸与50 mL 0.55 mol/L的氢氧化钠溶液在如图所示的装置中进行中和反应,通过测定反应过程中所放出的热量可计算中和热。回答下列问题: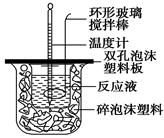
(1)烧杯间填满碎泡沫塑料的作用是___________________________
(2)环形玻璃搅拌棒能否用环形铁质搅拌棒代替?_____(填“能”或“不能”),
其原因是___________________________________________________________。
(3)实验时氢氧化钠溶液的浓度要用0.55 mol/L的原因是______________________。
实验中若改用60 mL 0.50 mol/L的盐酸与50 mL 0.55 mol/L的氢氧化钠溶液进行反
应,与上述实验相比,所放出的热量____________(填“相等”“不相等”),若实验操作均正确,则所求中和热________________(填“相等”“不相等”)。
(4)已知在稀溶液中,强酸和强碱发生中和反应生成1 mol H2O时,放出57.3 kJ的热量,则上述反应的热化学方程式为:__________________________________。
(9分)红葡萄酒密封储存时间越长,质量越好,原因之一是储存过程中生成了有香味的酯。在实验室也可以用如右下图所示的装置制取乙酸乙酯,请回答下列问题。
(1)乙醇分子中官能团的名称是___________;乙酸分子中官能团的名称是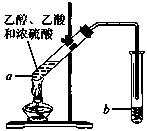
(2)试管a中加入几块碎瓷片的目的是____________。
(3)试管a中发生反应的化学方程式为______________________________,反应类型是________________________。
(4)反应开始前,试管b中盛放的溶液是____________。
(5)可用____________的方法把制得的乙酸乙酯分离出来。
石油资源紧张曾是制约中国发展轿车事业,尤其是制约轿车进入家庭的重要因素.据2004年5月23日的《扬子晚报》报道,中国宣布将推广“车用乙醇汽油”.乙醇完全燃烧生成CO2和H2O.
(1)写出乙醇完全燃烧的化学方程式______________________________________。
(2)乙醇燃烧时如果氧气不足,可能还有CO生成.用以下装置确证乙醇燃烧产物有CO、CO2、H2O,应将乙醇燃烧产物依次通过(按气流从左到右顺序填装置编号):__________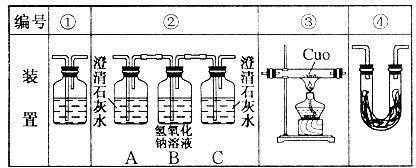
(3)实验时可观察到装置②中A瓶的石灰水变浑浊,C瓶的石灰水不变浑浊.A瓶溶液的作用是___________________________;B瓶溶液的作用是________________________;C瓶溶液的作用是______________________________________.
(4)装置③的作用是将CO氧化成CO2.装置①中所盛的是_________________溶液,作用是________________________________.
(5)装置④中所盛的固体药品是________________,它可以确证产生是____________.
某同学对“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”、“纸漏斗的下部被烧穿,有熔融物落入沙中”。查阅《化学手册》知,Al、Al2O3、Fe、Fe2O3熔点、沸点数据如下:
| 物质 |
Al |
Al2O3 |
Fe |
Fe2O3 |
| 熔点/℃ |
660 |
2054 |
1535 |
1462 |
| 沸点/℃ |
2467 |
2980 |
2750 |
—— |
(1)请写出铝热反应的化学反应方程式:_______________________。
(2)该同学推测铝热反应所得到的熔融物应是铁铝合金,理由是:该反应放出的热量使铁熔化,而铝的熔点比铁低,此时液态的铁和铝熔合形成铁铝合金。你认为他的解释是否合理?答:_________(填“合理”或“不合理”)。请写出铝热反应的一种工业用途______________________。
(3)设计一个简单的实验方案,证明上述所得的块状熔融物中含有金属铝。该实验所用试剂是_______,反应的离子方程式为_______ __________________。
(4)实验室要溶解该熔融物,下列试剂中可以选用____________(填序号)。
A.浓硫酸 B.稀硫酸 C.稀硝酸 D.氢氧化钠溶液