某同学对“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”、“纸漏斗的下部被烧穿,有熔融物落入沙中”。查阅《化学手册》知,Al、Al2O3、Fe、Fe2O3熔点、沸点数据如下:
| 物质 |
Al |
Al2O3 |
Fe |
Fe2O3 |
| 熔点/℃ |
660 |
2054 |
1535 |
1462 |
| 沸点/℃ |
2467 |
2980 |
2750 |
—— |
(1)请写出铝热反应的化学反应方程式:_______________________。
(2)该同学推测铝热反应所得到的熔融物应是铁铝合金,理由是:该反应放出的热量使铁熔化,而铝的熔点比铁低,此时液态的铁和铝熔合形成铁铝合金。你认为他的解释是否合理?答:_________(填“合理”或“不合理”)。请写出铝热反应的一种工业用途______________________。
(3)设计一个简单的实验方案,证明上述所得的块状熔融物中含有金属铝。该实验所用试剂是__ _____,反应的离子方程式为_______ __________________。
(4)实验室要溶解该熔融物,下列试剂中可以选用____________(填序号)。
A.浓硫酸 B.稀硫酸 C.稀硝酸 D.氢氧化钠溶液
下列A、B、C、D是中学常见的混合物分离或提纯的基本装置。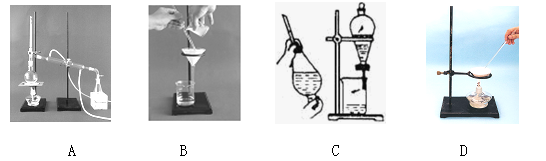
请根据混合物分离或提纯的原理,回答在下列实验中需要使用哪种装置。将A、B、C、D填入适当的空格中。
(1)除去Ca(OH)2溶液中悬浮的CaCO3;
(2)从碘水中提取碘;
(3)用自来水制取蒸馏水;
(4)分离植物油和水;
(5)除去粗盐中的泥沙;
(6)与海水晒盐原理相符的是。
某化学小组为了研究外界条件对化学反应速率的影响,进行了如下实验:
[实验原理]2KMnO4 + 5H2C2O4 + 3H2SO4 ="==" K2SO4 + 2MnSO4 + 10CO2↑ + 8H2O
[实验内容及记录]
| 实验编号 |
室温下,试管中所加试剂及其用量 / mL |
室温下溶液颜色褪至无色所需时间 / min |
|||
| 0.6 mol/L H2C2O4溶液 |
H2O |
0.2mol/L KMnO4溶液 |
3 mol/L 稀硫酸 |
||
| 1 |
3.0 |
2.0 |
3.0 |
2.0 |
4.0 |
| 2 |
3.0 |
3.0 |
2.0 |
2.0 |
5.2 |
| 3 |
3.0 |
4.0 |
1.0 |
2.0 |
6.4 |
请回答:
(1)根据上表中的实验数据,可以得到的结论是。
(2)利用实验1中数据计算,用KMnO4的浓度变化表示的反应速率为:υ(KMnO4) = 。
(3)该小组同学根据经验绘制了n(Mn2+)随时间变化趋势的示意图,如图1所示。但有同学查阅已有的实验资料发现,该实验过程中n(Mn2+)随时间变化的趋势应如图2所示。该小组同学根据图2所示信息提出了新的假设,并继续进行实验探究。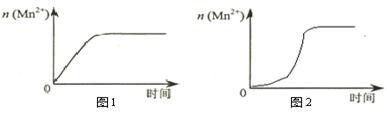
①该小组同学提出的假设是。
②请你帮助该小组同学完成实验方案,并填写表中空白。
| 实验编号 |
室温下,试管中所加试剂及其用量 / mL |
再向试管中加入少量固体 |
室温下溶液颜色褪至无色所需时间 / min |
|||
| 0.6 mol/L H2C2O4溶液 |
H2O |
0.2 mol/L KMnO4溶液 |
3 mol/L 稀硫酸 |
|||
| 4 |
3.0 |
2.0 |
3.0 |
2.0 |
t |
③若该小组同学提出的假设成立,应观察到的现象是。
化学上常用燃烧法确定有机物组成,这种方法是在电炉加热时用纯氧气氧化管内样品,根据产物的质量确定有机物的组成。图中所列装置是用燃烧法确定有机物分子式常用的装置。(每一组仪器只能使用一次)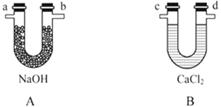
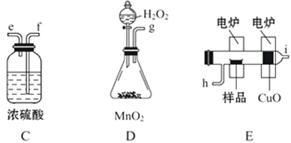
回答下列问题:
(1)产生的氧气按从左到右流向,所选择的装置各导管的连接顺序是_____ 。
(2)C装置中浓硫酸的作用是_____ 。
(3)D装置中MnO2的作用是_____ 。
(4)若准确称取7.2 g样品(只含C、H、O三种元素中的两种或三种),经充分燃烧后,A管质量增加22 g,B管质量增加10.8 g,则该有机物的最简式为_____ 。
(5)要确定该有机物的分子式,则_____ (填“是”或“不”)需要测定其他数据,若能确定其分子式,若其一氯代物只有一种,则其结构简式为_____ 。
二氯化二硫(S2Cl2)在工业上用于橡胶的硫化。为在实验室合成S2Cl2,某化学研究性学习小组查阅了有关资料,得到如下信息:
①将干燥的氯气在110 ℃~140 ℃与硫反应,即可得S2Cl2粗品。
②有关物质的部分性质如下表:
| 物质 |
熔点/℃ |
沸点/℃ |
化学性质 |
| S |
112.8 |
444.6 |
略 |
| S2Cl2 |
-77 |
137 |
遇水生成HCl、SO2、S;300 ℃以上完全分解: S2Cl2  S+SCl2 S+SCl2 |
设计实验装置图如下: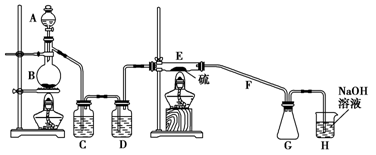
(1)上图中气体发生和尾气处理装置不够完善,请你提出改进意见。
利用改进后的正确装置进行实验,请回答下列问题:
(2)B中反应的离子方程式:;E中反应的化学方程式:。
(3)C、D中的试剂分别是、。
(4)仪器B的名称是,F的作用是。
(5)如果在加热E时温度过高,F中可能出现的现象是
(6)S2Cl2粗品中可能混有的杂质是(填写两种),为了提高S2Cl2的纯度,关键的操作是控制好温度和。
制印刷电路的废液含有大量CuCl2、FeCl2和FeCl3,测得某废腐蚀液中含CuCl21.5 mol·L-1、FeCl2 3.0 mol·L-1、FeCl3 1.0 mol·L-1、HCl 3.0 mol·L-1。取废腐蚀液200 mL按如下流程在实验室进行实验,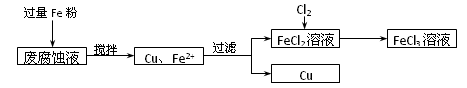
回答下列问题:
(1)用上述方法获得的铜粉中含有杂质,除杂所需试剂是__________;检验废腐蚀液中含有存在Fe2+的方法是______________________(注明试剂、现象)。
(2)实验室可用浓盐酸和固体MnO2反应制备Cl2。此反应中体现了盐酸的_________性质,反应的离子方程式为____________________。
利用图1制备Cl2并通入到FeCl2溶液中获得FeCl3溶液。请从图2中挑选所需的仪器,完成图1中的装置简图(可添加必要的塞子、玻璃导管、胶皮管。不画固定装置),并标明容器中所装试剂名称。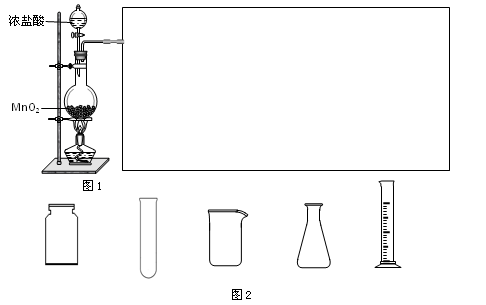
(3)按上述流程操作,需称取Fe粉的质量应不少于_____________g,需通入Cl2的物质的量不少于_______________mol。