制印刷电路的废液含有大量CuCl2、FeCl2和FeCl3,测得某废腐蚀液中含CuCl21.5 mol·L-1、FeCl2 3.0 mol·L-1、FeCl3 1.0 mol·L-1、HCl 3.0 mol·L-1。取废腐蚀液200 mL按如下流程在实验室进行实验,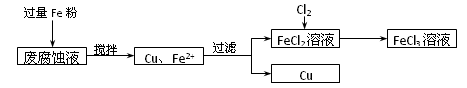
回答下列问题:
(1)用上述方法获得的铜粉中含有杂质,除杂所需试剂是__________;检验废腐蚀液中含有存在Fe2+的方法是______________________(注明试剂、现象)。
(2)实验室可用浓盐酸和固体MnO2反应制备Cl2。此反应中体现了盐酸的_________性质,反应的离子方程式为____________________。
利用图1制备Cl2并通入到FeCl2溶液中获得FeCl3溶液。请从图2中挑选所需的仪器,完成图1中的装置简图(可添加必要的塞子、玻璃导管、胶皮管。不画固定装置),并标明容器中所装试剂名称。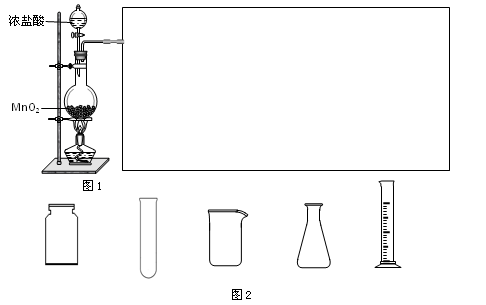
(3)按上述流程操作,需称取Fe粉的质量应不少于_____________g,需通入Cl2的物质的量不少于_______________mol。
化学兴趣小组为了探究常温下某未知气体的成分。该小组成员将气体通入澄清石灰水,发现澄清石灰水变浑浊,持续通入发现浑浊又变澄清,由此该小组成员对气体的成分提出猜想。
[提出猜想]
猜想1:该气体为CO2。
猜想2: 。
猜想3:该气体为CO2和SO2的混合气体。
为了验证猜测,该小组设计实验加以探究:
[实验探究]
该小组同学按如图所示装置,将气体从a端通入,则: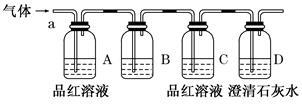
(1)B中应该装下列 试剂(填编号)。
| A.NaOH溶液 | B.酸性KMnO4溶液 |
| C.盐酸 | D.澄清石灰水 |
(2)B中溶液的作用是: 。
(3)D中澄清石灰水的作用是: 。
(4)通过该实验,该小组同学观察到以下三个实验现象:
①A中品红溶液褪色 ②C中品红溶液不褪色 ③D中澄清石灰水变浑浊
[得出结论]由上述现象该小组同学得出的结论为: 。
用如下图所示装置证明浓硫酸的强氧化性,并检验产物的性质。请回答:
(1)写出装置①中的化学方程式: 。
(2)装置③中反应的化学方程式: 。
(3)装置④中的现象可证明SO2有 性。
(4)装置⑥中反应的离子方程式为 。
用酸式滴定管准确移取25.00mL某未知浓度的盐酸溶于一洁净的锥形瓶中,然后用0.20mol·L -1的氢氧化钠溶液(指示剂为酚酞).滴定结果如下:
| NaOH起始读数 |
NaOH终点读数 |
|
| 第一次 |
0.10mL |
18.60mL |
| 第二次 |
0.30mL |
18.00mL |
(1)根据以上数据可以计算出盐酸的物质的量浓度为 mol·L-1.
(2)达到滴定终点的标志是
(3)以下操作造成测定结果偏高的原因可能是 。
A. 配制标准溶液的氢氧化钠中混有Na2CO3杂质
B. 滴定终点读数时,俯视滴定管的刻度,其它操作均正确
C. 盛装未知液的锥形瓶用蒸馏水洗过,未用待测液润洗
D. 滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液
E. 未用标准液润洗碱式滴定管
用酸式滴定管准确移取25.00mL某未知浓度的盐酸溶于一洁净的锥形瓶中,然后用0.20mol·L -1的氢氧化钠溶液(指示剂为酚酞).滴定结果如下:
| NaOH起始读数 |
NaOH终点读数 |
|
| 第一次 |
0.10mL |
18.60mL |
| 第二次 |
0.30mL |
18.00mL |
(1)根据以上数据可以计算出盐酸的物质的量浓度为 mol·L-1.
(2)达到滴定终点的标志是
(3)以下操作造成测定结果偏高的原因可能是 。
A. 配制标准溶液的氢氧化钠中混有Na2CO3杂质
B. 滴定终点读数时,俯视滴定管的刻度,其它操作均正确
C. 盛装未知液的锥形瓶用蒸馏水洗过,未用待测液润洗
D. 滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液
E. 未用标准液润洗碱式滴定管
某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:
①将碱式滴定管用蒸馏水洗净后,用待测溶液润洗后,再注入待测溶液,调节滴定管的尖嘴部分充满溶液,并使液面处于“0“刻度以下的位置,记下读数;将锥形瓶用蒸馏水洗净后,用待测溶液润洗锥形瓶2~3次;从碱式滴定管中放入25.00mL待测溶液到锥形瓶中.
②将酸式滴定管用蒸馏水洗净后,立即向其中注入0.1000mol/L标准盐酸,调节滴定管的尖嘴部分充满溶液,并使液面处于“0“刻度以下的位置,记下读数.
③向锥形瓶中滴入酚酞作指示剂,进行滴定.滴定至指示剂刚好变色,且并不马上变色为止,测得所耗盐酸的体积为V1mL.
④重复以上过程,但在滴定过程中向锥形瓶加入5mL的蒸馏水,测得所耗盐酸的体积为V2mL.试回答下列问题:
(1)锥形瓶中的溶液从 色变为 色时,停止滴定.
(2)滴定时边滴边摇动锥形瓶,眼睛应观察_________
A、滴定管内液面的变化 B、锥形瓶内溶液颜色的变化
(3)该小组在步骤①中的错误是 由此造成的测定结果 (偏高、偏低或无影响)
(4)步骤②缺少的操作是___________________________
(5)如图,是某次滴定时的滴定管中的液面,其读数为 mL
(6)
| 滴定次数 |
待测液体积(mL) |
标准盐酸体积(mL) |
|
| 滴定前度数(mL) |
滴定后度数(mL) |
||
| 第一次 |
25.00 |
0.50 |
20.40 |
| 第二次 |
25.00 |
4.00 |
24.10 |
请计算待测烧碱溶液的浓度 mol/L.