氨基甲酸铵(NH2COONH4)是一种白色固体,易分解、易水解,可用做肥料、灭火剂、洗涤剂等。某化学兴趣小组模拟工业原理制备氨基甲酸铵,反应的化学方程式如下:
2NH3(g)+CO2(g) NH2COONH4(s) ΔH<0
NH2COONH4(s) ΔH<0
(1)如用下图装置制取氨气,你所选择的试剂是 。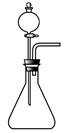
(2)制备氨基甲酸铵的装置如下图所示,把氨气和二氧化碳通入四氯化碳中,不断搅拌混合,生成的氨基甲酸铵小晶体悬浮在四氯化碳中。当悬浮物较多时,停止制备。
注:四氯化碳与液体石蜡均为惰性介质。
①发生器用冰水冷却的原因是: 、 。
液体石蜡鼓泡瓶的作用是: 。
②从反应后的混合物中分离出产品,为了得到干燥产品,应采取的方法是______ (填写选项序号)。
a.常压加热烘干 b.高压加热烘干 c.真空40 ℃以下烘干
③尾气处理装置如图所示。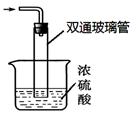
双通玻璃管的作用: ;
浓硫酸的作用: 、 。
(3)取因部分变质而混有碳酸氢铵的氨基甲酸铵样品11.73 g,用足量石灰水充分处理后,使碳元素完全转化为碳酸钙,过滤、洗涤、干燥,测得质量为15.00 g。则样品中氨基甲酸铵的物质的量分数为 。
某学生设计氨催化氧化实验,并将制得的NO进一步氧化为NO2,用水吸收NO2,并检验HNO3的生成。可供选择的固体药品有:NH4Cl、Ca(OH)2、KClO3、MnO2、CaO。可供选择的液体药品有:H2O2、浓盐酸、水。可供选择的仪器有: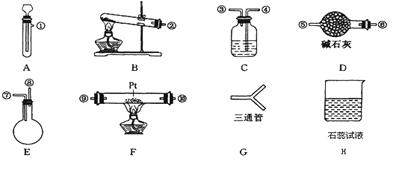
另有铁架台、铁夹、铁圈、乳胶管若干,可供选择。设计实验时,A和B两个制气装置均允许使用两次,其余装置只能使用一次。
(1)氨氧化制NO的化学反应应在装置中进行。
(2)制取NH3的装置最好选择,其化学反应方程式为;为快速制取O2的装置最好选择,其化学反应方程式为。
(3)各仪器按气流方向连接的正确顺序为:
A、B→G→→ F →→→ H。(按装置先后排列顺序补充完整)
(4)装置C的作用是。
( 5 ) 如果实验前需收集一试管的氨气,如何采用一种简易方法检验试管中
氨气是否集满(简述操作、现象和结论)?
(6)装置H中溶液显红色,其原因是
(7)请据以上实验事实设计一个实验来检验一份白色药品是铵盐,写出其正确
的实验操作步骤
如图所示,在一烧杯中盛有H2SO4溶液,同时有一表面光滑的塑料小球悬浮于溶液中央,向该烧杯中缓缓注入 Ba(OH)2溶液至恰好完全反应[设H2SO4和Ba(OH)2溶液密度相同]。试回答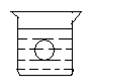
⑴此实验中,观察到的现象有:
①,②。
⑵写出实验过程中反应的离子方程式为。
按下列要求回答
(1)除去下列不纯物质中的少量杂质(括号内为杂质),请填入适当的试剂
①NO(NO2)②NH3(H2O)
(2)实验室配制100mL0.5mol·L‑1的Na2CO3溶液,回答下列问题:
①应用托盘天平称取碳酸钠粉末g。[来
②配制时应选用的仪器有500mL容量瓶,托盘天平、烧杯、药匙、。
③若实验时遇到下列情况,所配溶液的浓度偏大的是。
| A.加水定容时超过刻度线,又吸出少量至刻度线 |
| B.没有将洗涤液转入容量瓶 |
| C.容量瓶洗涤后内壁有水珠而未作干燥处理 |
| D.定容时府视刻度线 |
A—F六种元素中,除C外其他均为短周期元素,它们的原子结构或性质如下表所示:
| 元素 |
结构或性质 |
| A |
原子最外层电子数是内层电子总数的1/5 |
| B |
形成化合物种类最多的元素,其单质为固体 |
| C |
生活中常见的金属,它有两种常见的氯化物,且相对分子质量相差35.5 |
| D |
地壳中含量最多的元素 |
| E |
与D同主族 |
| F |
与E同周期,且最外层电子数等于电子层数 |
请回答下列问题:
(1)A在元素周期表中的位置是;A与E形成的化合物的电子式是。
(2)C的某种氯化物的浓溶液可以腐蚀印刷电路板上的金属铜,此反应的离子方程式是。
(3)B的单质与D的氢化物在一定条件下反应生成BD和另一产物的化学方程式是。
(4)F的盐酸盐水溶液呈酸性,原因是(用离子方程式表示);F的单质与C、D形成的相对分子质量为160的化合物在一定条件下反应的化学方程式是。
(5)A与F形成的合金是重要的工业材料。某同学仅使用天平和下图所示的装置,粗略测定某些数据即可求出该合金中A元素的含量。(装置中因空气质量引起的误差忽略不计)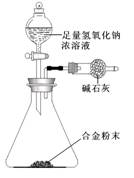
①实验需要测定三个物理量:合金的质量m以及a和b。
a是;
b是。
②合金中A元素的质量分数是(用含m、a、b的式子表示)。
Y是由硫的含氧酸盐组成的纯净物或者混合物,该物质可溶于水,食品工业常将它用作漂白剂、防腐剂、疏松剂、护色剂及保鲜剂等。化学兴趣小组在实验室对Y中硫元素的价态进行探究:①将过量的稀硝酸加入少量样品中,振荡;②取少许反应后的溶液,滴加硝酸钡溶液,出现白色沉淀。甲认为不能由此确定Y中硫的价态为+6价。
(1)上述实验中产生的沉淀是。
(2)你认为甲的判断是否正确(填“是”或“否”),作出这种判断的依据是。
(3)请完成对硫元素价态的探究:
限定实验仪器与试剂:烧杯、试管、玻璃棒、药匙、滴管和试管架;1mol·L-1H2SO4、2mol·L-1 HCl、2mol·L-1HNO3、3%H2O2、0.5mol·L-1BaCl2、品红试纸、蒸馏水。
①提出合理假设
假设1,硫的价态是+4价
假设2,硫的价态是+6价
假设3,
②设计实验方案证明你的假设
③实验过程
根据②的实验方案,进行实验。请写出实验步骤、预期现象与结论。
| 实验操作 |
预期的现象与结论 |
| 操作1 |
|
| 操作2 |